
【题目】某些化学问题可用相似的示意图来表示。下列说法不正确的是
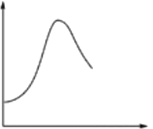
选项 | 横坐标 | 纵坐标 | 研究对象 |
A | 反应过程 | 能量 | NH4Cl和Ba(OH)2 ·8H2O反应 |
B | 反应温度 | 反应速率 | 酶催化反应 |
C | HCl溶液体积 | 沉淀质量 | 0.1 mol·L-1盐酸滴加到同浓度AgNO3溶液中 |
D | 反应时间 | 溶液温度 | 足量未打磨的镁条放在1mol·L-1H2SO4溶液中 |
A. A B. B C. C D. D
【答案】C
【解析】A项,NH4Cl和Ba(OH)2·8H2O的反应为吸热反应;B项,酶在正常体温时催化活性最好;C项,随着盐酸的滴入,沉淀增多,AgNO3完全反应时沉淀达最多,再加入盐酸,沉淀质量不再变化;D项,MgO、Mg与硫酸的反应是放热反应,开始一段时间温度升高,反应速率加快,单位时间内放热多,后来由于H2SO4的浓度减小,反应速率减慢,单位时间内放出的热量减少。
A项,NH4Cl和Ba(OH)2·8H2O的反应为吸热反应,反应物的总能量小于生成物的总能量,A项符合;B项,酶在正常体温(约37℃)时催化活性最好,反应速率最快,高于或低于此温度反应速率都减慢,B项符合;C项,随着盐酸的滴入,沉淀增多,AgNO3完全反应时沉淀达最多,再加入盐酸,沉淀质量不再变化,C项不符;D项,MgO、Mg与硫酸的反应是放热反应,开始一段时间温度升高,反应速率加快,单位时间内放热多,后来由于硫酸的浓度减小,化学反应速率减慢,单位时间内放出的热量减少,D项符合;答案选C。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中Q单质可制成半导体材料.下列判断正确的是( )
A.W形成的离子半径大于T形成的离子半径
B.W的单质在过量氧气中燃烧生成WO3
C.最高价氧化物的水化物的酸性:R<Q
D.T是地壳中含量最多的金属元素,其单质的化学性质较活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,由相同种类元素组成的是 ( )
A.胆固醇、脂肪酸、脂肪酶 B.淀粉、半乳糖、糖原
C.氨基酸、核苷酸、麦芽糖 D.性激素、脱氧核糖、胰岛素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类的生理作用的叙述中,不正确的是 ( )
A.核糖和脱氧核糖是核酸的组成成分
B.葡萄糖是细胞的主要能源物质
C.纤维素是植物细胞壁的主要成分
D.糖原是植物细胞中重要的储存能量的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用过滤的方法除去食盐中泥沙B.用蒸馏的方法将自来水制成蒸馏水
C.用水冲洗的方法从沙里淘金D.用酒精萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16gL﹣1,B可发生银镜反应.它们之间的转化关系如图:

请回答:
(1)有机物A中含有的官能团名称是____;
(2)反应④的原子利用率达100%,该反应的化学方程式是___________________________;
(3)将金属钠与有机物D反应所得的产物溶于水得饱和溶液,滴加2滴酚酞试液,加热后水溶液显红色,其原因是__________________________;(用离子方程式表示)
(4)下列说法正确的是________;
A.有机物C在一定条件下合成乙酸乙酯也能实现原子利用率100%
B.反应②、③、⑤的类型各不相同
C.由于乙酸乙酯和水均为无色液体,故用分液漏斗无法分离乙酸乙酯和水的混合物
D.相同条件下乙酸乙酯在氢氧化钠溶液中水解较在稀硫酸中更完全.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室将NH4Cl和Ca(OH)2各0.1mol固体混合共热,反应后的残渣溶于足量的蒸馏水中,得到的溶液中氨和Ca(OH)2皆为0.05mol (假设没有氨气逸出),在溶液中滴加一定浓度的盐酸,若Ca(OH)2为强碱,下列说法正确的是
A. n(HCl)=0.1mol,c(H+)+c(NH4+)>c(OH-)
B. n(HCl)=0.15mol,2c(H+)+2c(NH4+)=c(Ca2+)+2c(OH-)
C. n(HCl)=0.20mol,c(H+)+c(NH4+)=c(Ca2+)+c(OH-)
D. 残渣的组成为:n[(Ca(OH)2]=0.05 mol,n(CaCl2)=0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝及其化合物在生产和生活中有着广泛的应用.
(1)工业上冶炼铝的化学方程式是 .
(2)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3 , 则负极反应式为 .
(3)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护. 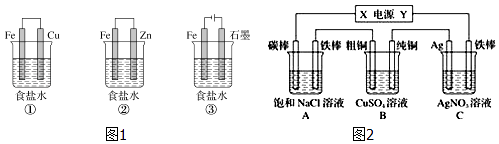
在相同条件下,三组装置中铁电极腐蚀最快的是(填序号),为防止金属Fe被腐蚀,可以采用上述(填序号)装置原理进行防护.
(4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,据此回答:则该电源电极Y名称为 , 流过导线的电子物质的量是 , A池中碳棒上的电极反应式是 , B池中粗铜电极上存在的电极反应式是 , C池中一段时间后硝酸银溶液浓度(填增大,减小或不变).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com