
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=cV结合物质的构成计算该题.
解答 解:(1)设质量都为mg,等质量的氧气(O2)和臭氧(O3),物质的量之比为$\frac{m}{32}$:$\frac{m}{48}$=3:2,则氧原子个数为3NA×2:2NA×3=1:1,.
故答案为:3:2;1:1;
(2)200mL 1mol/L AlCl3溶液和100mL 2mol/LAl2(SO4)3溶液所含Cl-和SO42-离子浓度之比为1mol/L×3:2mol/L×3=1:2;
Al3+离子物质的量之比为0.2L×1mol/L:0.1L×2mol/L×2=1:2,
故答案为:1:2;1:2.
点评 本题考查物质的量的相关计算,侧重于学生的分析和计算能力的考查,注意二者的摩尔质量和分子构成,难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为amL,实验后量气管的最终读数为bmL.请回答下列问题:
用如图所示装置测定Fe和Fe2O3的混合物中单质铁的质量分数(夹持部分已略去).称取Wg样品置于锥形瓶中,通过分液漏斗加入足量稀硫酸使样品完全溶解.实验前量气管起始读数为amL,实验后量气管的最终读数为bmL.请回答下列问题:| 序号 | 溶液中可能存在的金属离子 | 选择最少种数的试剂,验证该假设(填字母) |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 由于中国大部分地区都缺碘,而缺碘就会引起碘缺乏病,80年代国家强制给食用的氯化钠食盐中加入碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下:
氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下: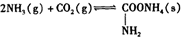
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 在铁件上镀铜时,金属铜作阴极 | |
| D. | 电解精炼铜时,电解质溶液中铜离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu2+ K+ Na+ SO42- | B. | K+ Na+ Cl-HCO3- | ||
| C. | Cl- NO3- Mg2+ NH4+ | D. | NO3- Na+ Cl-K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com