
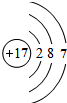
 应位于第3周期ⅤⅡA族,故答案为:3;ⅤⅡA;
应位于第3周期ⅤⅡA族,故答案为:3;ⅤⅡA;

科目:高中化学 来源: 题型:
| A、Q1<Q2 |
| B、Q1>Q2 |
| C、Q1=Q2 |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在10-15mL之间 |
| B、恰好在15mL处 |
| C、小于15mL |
| D、大于15mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
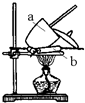 氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
氯化铁是常见的水处理剂.某氯化铁(FeCl3?6H2O)样品含有少量FeCl2杂质.现要测定其中FeCl3?6H2O的质量分数,实验按以下步骤进行:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图甲表示在纯水中加人0.0lmol.L-1NaOH溶液,Kw与NaOH溶液体积变化关系 | ||
B、图乙表示将1 mol?L-1 CH3COONa溶液加水稀释,溶液中
| ||
C、图丙表示0.1mol?L-1NH3?H2O加水稀释,溶液中
| ||
| D、图丁表示100 mLpH=2的HCl和CH3COOH加水稀释到1000 mL时pH变化与水的体积的变化关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物.写出下列反应的化学方程式及对应的反应类型:
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物.写出下列反应的化学方程式及对应的反应类型:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com