
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 元素X、Y能形成多种化合物 | |
| C. | 元素W的简单气态氢化物的热稳定性比X的弱 | |
| D. | Y、W最高价氧化物所对应的水化物均能溶解Z的氢氧化物 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的金属元素,则Z为Al元素;W原子序数大于Al,只能处于第三周期,X与W同主族,则X处于第二周期,Y的原子半径比X的大,二者不能同周期,则Y处于第三周期,只能为Na或Mg元素,由四元素原子最外层电子数之和为16,则X、Y、W原子最外层电子数之和为16-3=13,由奇偶性可知,Y只能处于奇数族,故Y为Na,则X、Y原子最外层电子数=$\frac{13-1}{2}$=6,则X为O元素、W为S元素,据此进行解答.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最高的金属元素,则Z为Al;W原子序数大于Al,只能处于第三周期,X与W同主族,则X处于第二周期,Y的原子半径比X的大,二者不能同周期,则Y处于第三周期,只能为Na或Mg元素,由四元素原子最外层电子数之和为16,则X、Y、W原子最外层电子数之和为16-3=13,由奇偶性可知,Y只能处于奇数族,故Y为Na,则X、W原子最外层电子数为:$\frac{13-1}{2}$=6,则X为O元素、W为S元素,
A.Y为Na、Z为Al、W为S,同周期自左而右原子半径减小,故原子半径:Y>Z>W,故A错误;
B.元素X、Y可以形成氧化钠、过氧化钠,故B正确;
C.X为O,W为S,非金属性O>S,则元素W的简单气态氢化物的热稳定性比X的弱,故C正确;
D.Y、W最高价氧化物所对应的水化物分别为NaOH、硫酸,Z的氢氧化物为氢氧化铝,氢氧化铝能溶于氢氧化钠、硫酸,故D正确;
故选A.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 正丁烷的燃烧热大于异丁烷,故正丁烷分子中的碳氢键比异丁烷的多 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 正丁烷转化为异丁烷的过程是一个放热过程 | |
| D. | 正丁烷分子储存的能量小于异丁烷分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 | |
| B. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 | |
| C. | 25℃下,在NH3•H2O稀溶液中,加水,$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值不变 | |
| D. | 在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B. | C. | D. |
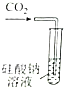 | 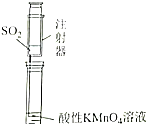 | 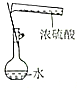 | 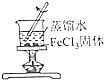 |
| 证明碳的非金属性比硅强 | 探究SO2的漂白性 | 配制一定物质的量浓度的稀硫酸 | 制取少量Fe(OH)3胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸不能将Fe氧化为Fe3+ |
| B | NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-与HCO3-发生双水解反应 |
| C | 向某溶液里滴加稀NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变 | 原溶液中无NH4+ |
| D | 将0.1mol•L-1MgSO4溶液滴入到NaOH溶液里至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的Ksp小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作室,锂电极反应式为Li-e-═Li+ | |
| B. | 若将石墨换成铁时,电池还能继续工作 | |
| C. | 电池工作时,电解质中的ClO4-运动到电池的石墨极 | |
| D. | 正极发生了还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com