
| A. | 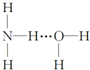 | B. | 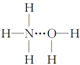 | C. | 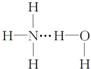 | D. | 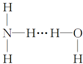 |
分析 氢键应形成于X…H-Y形式当中,X、Y必须是N、O、F元素之一,则氢键的存在有两种可能:(1)H3N…H-O-H;(2)H2N-H…OH2,结合氨水的电离生成铵根离子和氢氧根离子来解答.
解答 解:氢键应形成于X…H-Y形式当中,X、Y必须是N、O、F元素之一,结构可能为(1)H3N…H-O-H;(2)H2N-H…OH2;又由于一水合氨可电离出NH4+和OH-,所以(1)结构是合理的,如果是(2)则应电离出NH2-和H3O+,即NH3•H2O的结构式为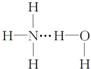 ,
,
故选C.
点评 本题考查共价键及氢键,为高频考点,把握氨气、水中的化学键及氢键的形成为解答的关键,侧重分析与应用能力的考查,注意一水合氨电离的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 60gSiO2晶体有σ键4NA | |
| B. | 在标准状况下,2.24 LSO3中含有的氧原子数为0.3NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 标准状况下,2.24LCl2通入足量H2O溶液中转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
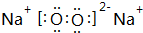 ,用电子式表示该化合物的形成过程
,用电子式表示该化合物的形成过程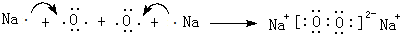 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
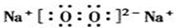 ;
;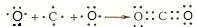 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| B. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
操作 | 现象 |
| 向盛有4g CaO2的大试管中加入10mL稀盐酸的溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴石蕊 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
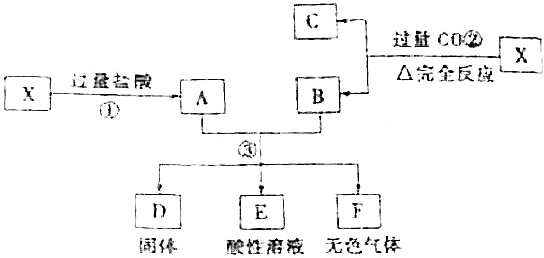
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com