
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
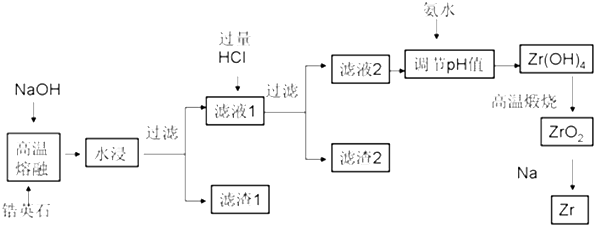
分析 锆英砂(主要成分为ZrSiO4,也可表示为ZrO2•SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,偏铝酸钠和过量盐酸反应得到氯化铝,滤渣2为H2SiO3,滤液中含有ZrO2+、Al3+,加氨水调节pH为2.4~2.7使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3;
(2)结合影响化学反应速率的因素分析,增大浓度、升高温度、增大接触面积、搅拌、多次浸取等分析;
(3)分析可知滤渣2为硅酸沉淀;
(4)根据表中数据判断;加氨水至pH=2.4时,ZrO2+与NH3•H2O反应生成Zr(OH)4沉淀;
(5)滤渣1为Fe2O3,加入盐酸溶液,制备氯化铁晶体时应防止铁离子水解,由溶液得到晶体,可进行蒸发浓缩、冷却结晶、过滤等操作.
解答 解:(1)高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,反应的化学方程式为:ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O,
故答案为:ZrSiO4+4NaOH=Na2ZrO3+Na2SiO3+2H2O;
(2)为了提高浸出率可采取的方法有,将原料粉碎增大接触面积、加热、搅拌、多次浸取,
故答案为:原料粉碎增大接触面积、加热或搅拌或多次浸取;
(3)二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,偏铝酸钠和过量盐酸反应得到氯化铝,Na2SiO3与HCl生成硅酸沉淀,滤渣2为H2SiO3或 H4SiO4,
故答案为:H2SiO3 或 H4SiO4;
(4)滤液2中含有ZrO2+、Al3+,依据图表数据分析可知,加氨水调节pH为2.4~2.7使ZrO2+转化为Zr(OH)4沉淀,铝离子不沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2;
故答案为:2.4≤pH<3.4;使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来;
(5)滤渣1为Fe2O3,加入盐酸溶液,过滤不溶物后得到滤液为氯化铁溶液,再将滤液在不断通入HCl气流中蒸发结晶,防止氯化铁水解生成氢氧化铁沉淀,同时蒸发浓缩、冷却结晶、过滤可回收得到铁的氯化物FeCl3晶体.
故答案为:HCl气流中;冷却结晶、过滤.
点评 本题考查了物质制备的流程,为高考常见题型.侧重于学生的分析能力和实验能力的考查,题目涉及混合物分离、提纯及化学方程式的方法、物质性质的应用,综合性较强,题目难度中等.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2n(C)+n(N)+2 | B. | 2n(C)+2n(N)+n(O) | C. | 3n(C)+2n(O)+2 | D. | 2n(C)+2n(N)+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
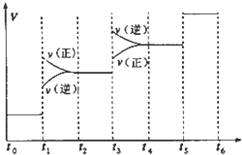
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
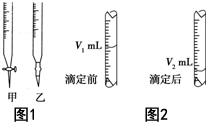 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
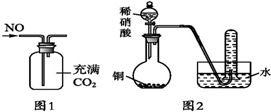
| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
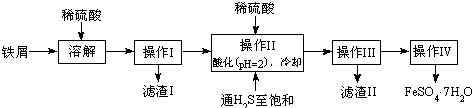
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
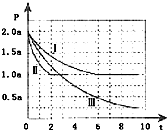
 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com