
| A、反应①中Se是氧化产物,I2是还原产物 |
| B、反应②中浓H2SO4是氧化剂,SeO2是还原产物 |
| C、反应①中每有1.0mol I2生成,转移电子数目为4NA |
| D、SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、在含有大量AlO2-的溶液中,NH4+、Na+、Cl-、H+可能大量共存的离子 |
| B、25℃水电离出的c(H+)=10-13mol/L的溶液中,Ba2+、I-、NO3-、Cl-一定能大量共存 |
| C、Fe(OH)3溶于HBr溶液的离子方程式:2Fe(OH)3+6H++2Br-=2Fe2++Br2+6H2O |
| D、少量的CO2通入苯酚钠溶液中离子方程式:C6H5O-+CO2+H2O=C6H5OH+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同时增大 | B、同时减小 |
| C、增大,减小 | D、减小,增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,33.6LCl2与足量Fe反应,转移的电子数为3NA |
| B、1molNO2与足量H2O反应,转移电子数为NA |
| C、由CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA |
| D、熔融状态下1molNaHSO4中阳离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
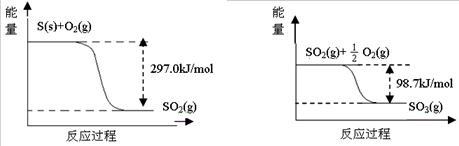
| A、1mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0kJ/mol | ||
B、一定条件下1molSO2(g)和
| ||
| C、在相同条件下,SO3(g)比SO2(g)稳定 | ||
D、S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钾跟水反应 2K+2H2O=2K++2OH-+H2↑ |
| B、铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
| C、氢氧化钡溶液跟硫酸反应 Ba2++SO42-=BaSO4↓ |
| D、碳酸钙跟盐酸反应 CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1molNaCl溶于1 L水中,所得溶液的物质的量浓度为1mol/L |
| B、将2molKCl溶于适量水中,配成1L溶液,所得溶液的物质的量浓度为2mol/L |
| C、将3molCuSO4溶于1000 g水中,所得溶液的物质的量浓度为3mol/L |
| D、将4molNaOH溶于适量水中,配成1000 g 溶液,所得溶液的物质的量浓度为4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
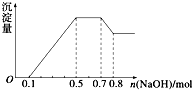 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A、溶液中的阳离子有H+、Mg2+、NH4+、Al3+ |
| B、溶液中n (Al3+)=0.2mol |
| C、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| D、n(H+):n(Al3+):n(Mg2+)=2:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com