
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | NO2通入水中,红棕色逐渐褪去 | |
| C. | 往硝酸银溶液中滴加盐酸产生白色沉淀 | |
| D. | 甲烷和氯气在光照下反应,黄绿色逐渐褪去 |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应,根据定义分析解答.
解答 解:A.乙烯通入溴的四氯化碳溶液,溴和乙烯发生反应生成1,2-二溴乙烷,使溴水褪色,属于加成反应,故A正确;
B.NO2 通入水中,气体由红棕色逐渐转变为无色,是由于反应生成NO和硝酸,N元素化合价发生变化,属于氧化还原反应,故B错误;
C.离子能和银离子的溶液反应,会产生白色沉淀,发生复分解反应,故C错误;
D.甲烷与氯气混合光照,甲烷中的氢原子被氯原子所代替生成氯代物而使黄绿色消失,属于取代反应,故D错误.
故选A.
点评 本题主要考查了加成反应的判断,难度不大,注意乙烯含有碳碳双键,性质较活泼,能被酸性高锰酸钾溶液氧化成二氧化碳.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、AlO2-、Cl- | B. | Mg2+、Cu2+、SO42-、HCO3- | ||
| C. | Fe3+、Na+、SCN-、CO32- | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | XY2与ZY2中的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O的反应热△H=-2×57.3 kJ/mol | |
| B. | 已知S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395.7 kJ/mol,则硫磺的燃烧热为395.7 kJ/mol | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则金刚石比石墨稳定 | |
| D. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则H2的燃烧热为285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
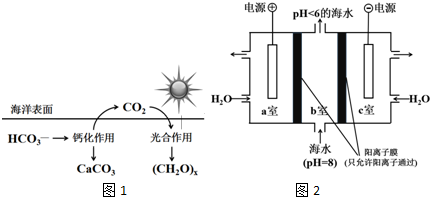
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数 | B. | 分子数 | C. | 体积 | D. | 物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
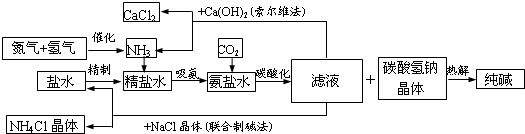
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现向一密闭容器中充入1molN2和3molH2,在一定条件下使该反应发生,达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| B. | 把NaHCO3和Na2CO3混和物6.85g溶于水制成100mL溶液,其中c(Na+)=1mol•L-1.该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量无法计算 | |
| C. | 将54.4g铁粉和氧化铁的混合物中加入4.0mol/L 200mL的稀硫酸,恰好完全反应,放出氢气4.48L.反应后的溶液中滴加KSCN不显红色,且无固体剩余物,反应后得到FeSO4的物质的量是0.8mol | |
| D. |  某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是H+、NH4+、Mg2+、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com