
【题目】25℃时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分数)与pH的关系如下图所示。下列叙述不正确的是( )
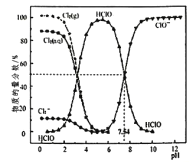
A. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断变浅
B. 新制的pH=l的氯水中,c(H+)>c(Cl3-)>c(HClO)
C. 25℃时,HC1O![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为Cl2+2OH-=ClO-+C1-+H2O
【答案】D
【解析】A. 新制氯水中存在氯气和水的反应:Cl2+H2O![]() HCl+HClO,该反应是可逆反应,生成的HClO具有强氧化性,SO2具有还原性,可以和HClO发生氧化还原反应,HClO的浓度减小,则平衡正向移动,HCl的浓度增大,溶液酸性增强,pH减小,Cl2的浓度减小,所以溶液的颜色变浅,故A正确;B. 根据图象可知,pH=1时,c(Cl3-)>c(HClO)且二者的分布分数都很小,因pH=1,溶液中c(H+)=0.1mol/L,所以溶液中c(H+)比较大,则c(H+)>c(Cl3-)>c(HClO),故B正确;C. HC1O
HCl+HClO,该反应是可逆反应,生成的HClO具有强氧化性,SO2具有还原性,可以和HClO发生氧化还原反应,HClO的浓度减小,则平衡正向移动,HCl的浓度增大,溶液酸性增强,pH减小,Cl2的浓度减小,所以溶液的颜色变浅,故A正确;B. 根据图象可知,pH=1时,c(Cl3-)>c(HClO)且二者的分布分数都很小,因pH=1,溶液中c(H+)=0.1mol/L,所以溶液中c(H+)比较大,则c(H+)>c(Cl3-)>c(HClO),故B正确;C. HC1O![]() H++ClO-的电离常数Ka =
H++ClO-的电离常数Ka = ![]() ,因pH=7.54时,c(HClO)= c(ClO-)所以此时Ka=c(H+)=10-7.54,则lgKa =7.54,故C正确;D. 由图可知,pH=6时,溶液中存在的主要物质是HClO,而ClO-很少,因此pH=6的氯水中加入NaOH溶液,主要的生成物应该是HClO而不是ClO-,故D错误;答案选D。
,因pH=7.54时,c(HClO)= c(ClO-)所以此时Ka=c(H+)=10-7.54,则lgKa =7.54,故C正确;D. 由图可知,pH=6时,溶液中存在的主要物质是HClO,而ClO-很少,因此pH=6的氯水中加入NaOH溶液,主要的生成物应该是HClO而不是ClO-,故D错误;答案选D。


科目:高中化学 来源: 题型:
【题目】重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O![]() 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
A. 向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄
B. 氧化性:Cr2O72->Fe3+
C. CrO42-和Fe2+在酸性溶液中能大量共存
D. 向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X,Y,Z,W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法正确的是( ) 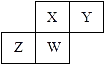
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:Z>W>X
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素Y,Z形成的化合物是制造光电池的主要材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2min内,用NO表示该反应的平均速率v(NO)=molL﹣1min﹣1 .
(2)该反应的化学方程式是 .
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是 .
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
①a处通入的物质是 , 电极反应式为:;
②b处电极反应式为;
③电池工作时H+由极移向极(填正、负极).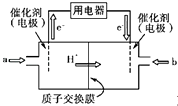
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.氯化钠与浓硫酸混合加热:H2SO4(浓)+2Cl﹣ ![]() SO
SO ![]() +2HCl↑
+2HCl↑
B.过量的硫化钠溶液与氯化铁溶液反应:2Fe3++S2﹣═2Fe2++S↓
C.碳酸氢铵溶液与足量NaOH溶液混合后加热:NH ![]() +HCO
+HCO ![]() +2OH﹣
+2OH﹣ ![]() CO
CO ![]() +NH3↑+2H2O
+NH3↑+2H2O
D.向次氯酸钙溶液中通入少量SO2:Ca2++2ClO﹣+SO2+H2O═CaSO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com