
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| C、元素Y的简单气态氢化物的热稳定性比Z的强 |
| D、元素Z、W的简单离子的电子层结构不同 |


科目:高中化学 来源: 题型:
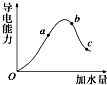 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发展循环经济,构建资源节约型社会 |
| B、加高工厂的烟囱,使烟尘和废气远离地表,减少污染 |
| C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃 |
| D、采用“绿色化学”工艺,建立环境友好型化工体系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe2++I2=2Fe3++2I- |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、H2O2+SO2=H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | - |
| 2 | 0.1mol | 0.3mol | - | 0.1mol |
| A、只有n(K+)相同 |
| B、只有n(Cl-)相同 |
| C、各离子的物质的量均不同 |
| D、各离子的物质的量完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
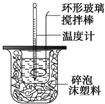 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com