
【题目】下列物质可以在乘车、船或飞机时较大量随身携带的是( )
A. 浓硫酸 B. 高锰酸钾 C. 硫黄 D. 硫酸钾
科目:高中化学 来源: 题型:
【题目】某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)铁与水蒸气反应的化学方程式为______________________________________。
(2)加入试剂1后溶液呈淡红色,则淡黄色溶液中含有________(填离子符号)。加入试剂1后溶液呈红色的原因是(用离子方程式表示)________________。
(3)加入新制氯水后溶液红色加深的原因是(结合离子方程式说明) ___________________。
(4)一段时间后深红色溶液褪色的原因可能是①溶液中+3铁被氧化为更高的价态;②_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫分子(如图)呈正八面体,难以水解,在电器工业方面有着广泛用途。下列有关SF6的推测正确的是( )
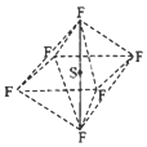
A. 高温条件下,SF6微弱水解生成H2SO4和HF
B. SF6易燃烧生成二氧化硫
C. SF6中各原子均达到 8 电子稳定结构
D. 六氟化硫分子中的S—F键都是σ键,键长、键能不完全相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4N3(叠氮化铵)易发生爆炸反应: NH4N3![]() 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解质电离的下列说法中正确的是
A.电离是电解质解离为自由移动离子的过程
B.电解质溶于水时都能发生电离
C.电解质受热熔化时都能发生电离
D.电解质通电时才能发生电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在医药生产中有许多重要用途。请回答下列问题:
(1)砷与同周期第ⅦA族的溴的第一电离能相比,较大的是_______________________。
(2)气态氢化物稳定性:NH3 ______________ AsH3,其主要原因是___________________。
(3)①肼(N2H4)分子可视为NH3分子中的一个氢原子被NH2(氨基)取代形成的另一种氮的氢化物。则N2H4电子式为_______________。
②工业上将NH3或(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为_______________,1 mol(CH3)2 CO中的π键数目为___________。
③N2H4分子中存在的共价键类型有________(填选项字母)。
A.非极性键 B.极性键 C.s-s σ键 D.s-p σ键
E.p-p π键 F.s-sp3 σ键 G.sp3-sp3 σ键 H.sp3-sp3 π键
(4)已知N2H5+与N2H62+是由中性分子结合质子形成的,有类似于 NH4+的性质。
①写出N2H62+在碱性溶液中反应的离子方程式:_________________________________。
②据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是____________。
(5)Na3AsO4可作杀虫剂。AsO![]() 的空间构型为__________,与其互为等电子体的一种分子为________。
的空间构型为__________,与其互为等电子体的一种分子为________。
(6)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为__________,砷原子采取___________杂化。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道美国准备试验绿色航天推进剂-离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,结构如图,它比肼燃烧释放能量更高,更安全、环保。下列说法不正确的是( )

A.羟基硝酸铵中各原子共平面
B.固态时羟基硝酸铵是离子晶体
C.羟基硝酸铵中含有离子键和共价键
D.9.6g羟基硝酸铵中含有0.2NA个离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从1L1 mol/L的NaOH溶液中,取出50mL溶液,该50mL NaOH溶液的物质的量浓度为
A.0.02mol/L B.0.2mol/L C.1 mol/L D.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com