
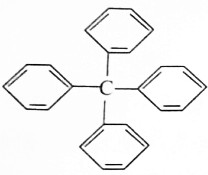
 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:| A. | 分子式为C25H20 | |
| B. | 所有碳原子都在同一平面上 | |
| C. | 此物质属于芳香烃类物质 | |
| D. | 该物质中既含有极性键又含有非极性键 |
分析 A.分子中含有4个苯环,共含有25个C原子和20个H原子;
B.含有甲烷的四面体结构,所有碳原子不可能在同一平面上;
C.含有苯环的烃属于芳香烃;
D.碳原子之间形成非极性键,C原子与H原子之间形成极性键.
解答 解:A.分子中含有4个苯环,共含有25个C碳原子和20个H原子,则分子式为C25H20,故A正确;
B.分子中含有甲烷的四面体结构,所有碳原子不可能在同一平面上,故B错误;
C.该有机物含有苯基,且只含C和H元素,为芳香烃类物质,故C正确;
D.碳原子之间形成非极性键,C原子与H原子之间形成极性键,故D正确.
故选B.
点评 本题考查有机物的结构和性质,注意根据甲烷四面体、乙烯与苯的平面结构、乙炔的直线形判断共面与共线问题,熟练掌握官能团的结构与性质.


科目:高中化学 来源: 题型:选择题
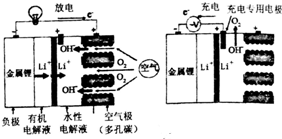
| A. | 充电时,锂离子向阴极移动 | |
| B. | 充电时阴极电极反应式为:Li++e-═Li | |
| C. | 放电时正极电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 负极区的有机电解液可以换成水性电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 植物油萃取 | 溴在植物油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨水具有挥发性 | |
| B. | 1mol/L氨水溶液的pH=10 | |
| C. | 1mol/LNH4Cl溶液的pH=5 | |
| D. | 氨水与AlCl3溶液反应生成Al(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
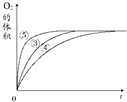 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属质量(g) | 金属状态 | C(H2SO4)(mol/L) | V(H2SO4)(mL) | 溶液温度(℃) | 金属消失的时间(s) | |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 数据模糊 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 数据模糊 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 数据丢失 | 44 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除②外 | B. | 全部 | C. | ③⑤⑦ | D. | ①③④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com