
| A、① | B、②③④ |
| C、③④ | D、①②③④ |
| m |
| M |
| V |
| Vm |
| n |
| c |
| 2.04g |
| 17g/mol |
|
| 2.24L |
| 22.4L/mol |
| 0.02mol |
| 0.1mol |
| 1.28mol |
| 2mol/L |


科目:高中化学 来源: 题型:
| A、用纯碱溶液清洗油污时,加热可以增强其去污能力 |
| B、区别NaCl、NH4Cl、Na2CO3三种无色透明溶液用pH试纸鉴别,pH=7的是NaCl溶液,pH<7的是NH4Cl溶液,pH>7的是Na2CO3溶液 |
| C、用氯化铝(AlCl3 )溶液和硫化钠(Na2S)溶液混合制取硫化铝(Al2S3)溶液 |
| D、常温下相同物质的量浓度碳酸钠溶液和醋酸钠溶液,其pH值前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1组 | B、2组 | C、3组 | D、4组 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能 I1 I2 I3 I4 … |
| In/kJ.mol-1 578 1817 2745 11578 … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合气体的平均摩尔质量为23.2g/mol |
| B、混合气体与Na2O2反应过程中电子转移的物质的量为0.25mol |
| C、溶液中SO32-的物质的量浓度基本保持不变 |
| D、溶液中HCO3-的物质的量浓度减小,CO32-的物质的量浓度增大,但是加入“剩余固体”充分反应后溶液中HCO3-和CO32-的物质的量浓度之和与加入“剩余固体”前基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| B、在某试样中加入NaOH溶液加热,产生能使蓝色石蕊试纸变红的气体即证明有NH4+ |
| C、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
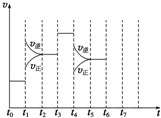 在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com