
(1)3.4 g醇中C、H、O的物质的量分别为:
n(C)=______ mol,n(H)=______ mol,n(O)=______ mol;该醇中C、H、O原子数之比为:__________。
(2)从以上比值能否确定该醇的分子式?其原因是_______________________________。
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:黑龙江省大庆实验中学2010-2011学年高一下学期开学测试化学试题 题型:022
下列关于实验的说法正确的是________
A.把40 g NaOH固体放入1000 ml水中,即可配制1.00 mol/L的NaOH溶液
B.实验室配置1 mol/L的盐酸250 ml,只需要托盘天平、胶头滴管、250 ml容量瓶、烧杯
C.在配置一定物质的量浓度的KOH溶液时,容量瓶洗净后未干燥、定容时仰视观察均可以造成实验结果偏低
D.实验室需要480 ml 0.1 mol/L的硫酸铜溶液,可以用500 ml的容量瓶配置,需要称取胆矾12.5 g
E.制备Fe(OH)3胶体是将饱和FeCl3溶液滴入沸腾的蒸馏水中,继续煮沸至溶液呈红褐色
F.通过渗析可以除去淀粉溶液中的氯化钠,通过丁达尔现象可以区别Fe(OH)3胶体和FeCl3溶液
G.为提高高锰酸钾的氧化能力,可以用盐酸进行酸化
H.将具有漂白性的Cl2和SO2等物质的量通入水中,溶液几乎没有漂白能力
查看答案和解析>>
科目:高中化学 来源:如东县2007年高考化学模拟试题(一) 题型:038
将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
Ⅰ、取50.0 mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
Ⅱ、另取50.0 mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
Ⅲ、再取50.0 mL混合溶液,向其中加入20.0 mL稀硝酸,到一种无色气体,其体积换算成标准状况时为0.448 L;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
(2)所得混合溶液中c(Cu2+)的取值范围;
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
查看答案和解析>>
科目:高中化学 来源:山东省潍坊市2012届高三一轮模拟考试化学试题 题型:058
绿矾(FeSO4·7H2O)是治疗缺铁性盆血药品的重要成分.实验室利用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备绿矾的过程如下:

(1)固体W焙烧时产生某有毒气体,需以碱液吸收处理之,下列装置A~D中可选用________(填字母);若选用E装置,则烧杯中的下层液体可以是________(填名称).
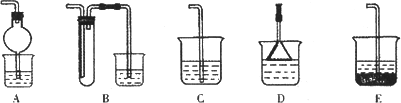
(2)实验过程中多次使用过滤操作.过滤操作中用到的玻璃仪器有________.
(3)写出溶液X中加铁屑发生反应的离子方程式________.
(4)测定绿矾产品中Fe2+含量的实验步骤:
a.称取5.7 g绿矾产品,溶解,在250 mL容量瓶中定容;
b.量取25 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40 mL(滴定时发生反应的离子方程式为:5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O)
+8H+=5Fe3++Mn2++4H2O)
①计算上述产品中FeSO4·7H2O的质量分数为________.
②若用上述方法测定的产品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有(只回答一条即可)________.
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
阿斯匹林(aspirin)的有效成分是乙酰水杨酸,它是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能。阿斯匹林是由水杨酸(邻羟基苯甲酸)与乙酸酐进行酯化反应而得的。

水杨酸 乙酸酐 乙酰水杨酸
(1)乙酰水杨酸的含氧官能团分别是_____________和酯基。
(2)乙酰水杨酸能在稀酸和NaOH溶液中水解。写出乙酰水杨酸与稀酸溶液共热的化学方程式:___________。
(3)写出同时符合下列四个要求的水杨酸的同分异构体: 。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH发生反应;
④只能生成两种一氯代产生。
(4)已知酚羟基遇FeC13溶液显紫色,但显色反应要在中性或弱酸性溶液进行。现要求用已有的知识检验出乙酰水杨酸分子中存在酯基。有人设计了如下的实验方案:
取一支洁净的试管,向其中加入2mL阿斯匹林清液,然后再滴入2 滴稀硫酸,将溶液在酒精灯上加热片刻后,滴入2滴FeC13溶液,振荡,无明显现象;再向其中逐滴加入Na2CO3溶液,振荡,出现了紫色。你认为逐滴加入Na2CO3溶液的目的是_____________。从此实验你得到的启示有_____________。
(5)为测定阿斯匹林中有效成分的含量,称取样品0.250 0 g ,准确加入浓度为0.1015 mol?L- NaOH溶液50.00 mL,煮沸60min。冷却后用浓度为0.1015 mol?L- 的HC1溶液返滴过量的NaOH,消耗HC1溶液记录如下:
| 数据 次数 | 1 | 2 | 3 |
| 初始读数 | 2.00 | 12.50 | 5.20 |
| 最后读数 | 27.10 | 37.40 | 33.20 |
则该产品中乙酰水杨酸的含量为(乙酰水杨酸的摩尔质量是180.16 g?mol- 。(只要求列式表示,不计算出最后结果)____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com