
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 向试管中滴加液体时,胶头滴管垂直试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液的pH不变 | |
| B. | 原电池的正极和电解池的阴极所发生的反应都是还原反应 | |
| C. | 电解精炼铜时粗钢作阳极、精铜作阴极、溶液中含有铜离子 | |
| D. | 在铁制品上镀锌的方案设计是锌作阳极、镀件作阴极、溶液中含有锌离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①②③④均属于氧化还原反应 | |
| B. | 反应①中的单质C为还原剂 | |
| C. | 反应④中CaCO3既是氧化剂又是还原剂 | |
| D. | 反应①②③④所属的基本反应类型依次为:置换、复分解、化合、分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
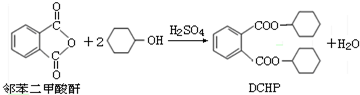
| A. | 邻苯二甲酸酐的二氯代物有2种 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | DCHP能发生加成反应、取代反应、消去反应 | |
| D. | 1molDCHP可与氢氧化钠溶液反应,最多可消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| B. | 解释化学反应速率理论有碰撞理论和过渡态理论,其中过渡态理论可解释温度、催化剂等因素对化学反应速率的影响 | |
| C. | 离子交换膜在工业上应用广泛,如氯碱工业使用阳离子交换膜 | |
| D. | 用氨水法处理燃煤烟气中的二氧化硫,既可消除其污染,又可得到副产品硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁跟稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 盐酸滴入氢氧化钡溶液中:H++OH-=H2O | |
| D. | 氯气通入NaOH溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
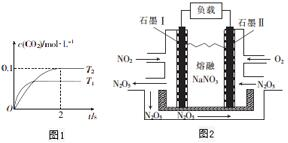 汽车尾气和燃煤尾气是造成空气污染的原因之一.
汽车尾气和燃煤尾气是造成空气污染的原因之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com