
| A、在两支试管中分别加1mL无水乙醇和1.5g苯酚固体,再加等量的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| B、为降低铜锌原电池中的极化作用,可在电解质溶液中加入少量双氧水 |
| C、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加2mL的水,以防过滤时硝酸钾晶体过早析出 |
| D、为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、2g H218O中含有NA个中子 |
| B、标准状况下,14g CO气体中含有的原子数为0.5NA |
| C、0.1mol NH3分子中含有0.9NA个电子 |
| D、2.24L CH4气体中所含原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X、Y、Z元素分别为N、P、O |
| B、白格中都是主族元素,灰格中都是副族元素 |
| C、原子半径:Z>X>Y |
| D、X、Y、Z的气态氢化物中最稳定的是:X的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- |
| B、放电过程电子从正极流向负极 |
| C、放电时溶液中正极附近OH-浓度变小 |
| D、充电时电解质溶液中的OH-向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对钢材“发蓝”(钝化) |
| B、选用铬铁合金 |
| C、外接电源负极 |
| D、连接锌块 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1表示pH相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| B、图1表示物质的量浓度相同的盐酸和醋酸加水稀释时溶液导电能力的变化 |
| C、图2中,t℃时饱和溶液的质量分数为m% |
| D、图2中,若保持温度不变,可以通过添加溶质的方法使溶液组成从a点变为b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| A、使用催化剂不影响反应速率 |
| B、降低体系温度能加快反应速率 |
| C、增加O2的浓度能加快反应速率 |
| D、一定条件下达到反应限度时SO2全部转化为SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
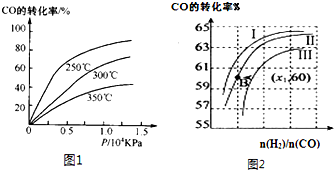
| n(H2) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y、Z、X、W的原子序数依次减小 |
| B、X的简单氢化物的沸点低于Y的简单氢化物的沸点 |
| C、由W、X、Y、Z四种元素组成的常见化合物可能显强酸性 |
| D、W与X可形成既含极性共价键又含非极性共价键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com