
【题目】C1O2作为一种强氧化剂,是国际上公认的高效消毒灭菌剂,但因其易爆有毒,常用NaClO2替代。常温下,将NaOH固体加入到由0.1molC1O2溶于水配成的1L溶液中。溶液pH及部分组分含量变化曲线如图,下列叙述不正确的是

(已知:2C1O2+H2O![]() HC1O2+H++C1O3-)
HC1O2+H++C1O3-)
A. Ka(HClO2)≈10-4.5
B. 不能用pH试纸测该溶液的pH
C. 酸性:HClO2<HClO3,氧化性:HClO2>HClO3
D. 该图像上任何一点,都有c(C1O2-)+c(HC1O2)+c(C1O3-)=0.1mol·L-1
【答案】D
【解析】A项,HClO2的电离方程式为HClO2![]() H++ClO2-,HClO2的电离平衡常数Ka(HClO2)=
H++ClO2-,HClO2的电离平衡常数Ka(HClO2)=![]() ,根据图像当c(HClO2)=c(ClO2-)时溶液的pH
,根据图像当c(HClO2)=c(ClO2-)时溶液的pH![]() 4.5,Ka(HClO2)
4.5,Ka(HClO2)![]() 10-4.5,A项正确;B项,溶液中的ClO2、HClO2、ClO2-具有强氧化性,能使pH试纸褪色,不能用pH试纸测该溶液的pH,B项正确;C项,根据题给反应的离子方程式可见,HClO2为弱酸,HClO3为强酸,酸性:HClO2
10-4.5,A项正确;B项,溶液中的ClO2、HClO2、ClO2-具有强氧化性,能使pH试纸褪色,不能用pH试纸测该溶液的pH,B项正确;C项,根据题给反应的离子方程式可见,HClO2为弱酸,HClO3为强酸,酸性:HClO2![]() HClO3,一般同一元素不同氧化态的含氧酸中,低氧化态含氧酸的氧化性较强,氧化性:HClO2
HClO3,一般同一元素不同氧化态的含氧酸中,低氧化态含氧酸的氧化性较强,氧化性:HClO2![]() HClO3,C项正确;D项,根据2ClO2+H2O
HClO3,C项正确;D项,根据2ClO2+H2O![]() HClO2+H++ClO3-、HClO2
HClO2+H++ClO3-、HClO2![]() H++ClO2-,溶液中的物料守恒为c(ClO2)+c(HClO2)+c(ClO2-)+c(ClO3-)=0.1mol/L,D项错误;答案选D。
H++ClO2-,溶液中的物料守恒为c(ClO2)+c(HClO2)+c(ClO2-)+c(ClO3-)=0.1mol/L,D项错误;答案选D。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】化合物G是一种治疗帕金森症的药品,其合成路线流程图如下:
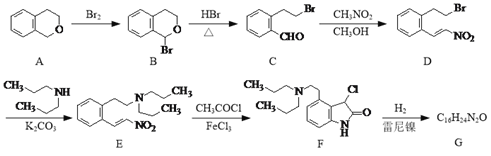
(1)D中的官能团名称为溴原子、______和______。
(2)B、C、D三种有机物与NaOH乙醇溶液共热,能发生消去反应的是____(填字母)。
(3)写出同时满足下列条件的D的一种同分异构体的结构简式:______。
①分子中只有3种不同化学环境的氢;
②能发生银镜反应,苯环上的一取代物只有一种。
(4)F通过取代反应得到G,G的分子式为C16H24N2O,写出G的结构简式:______。
(5)已知:![]() (R代表烃基或H)。
(R代表烃基或H)。
请写出以![]() 和CH3NO2为原料制备
和CH3NO2为原料制备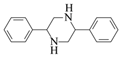 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。__________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
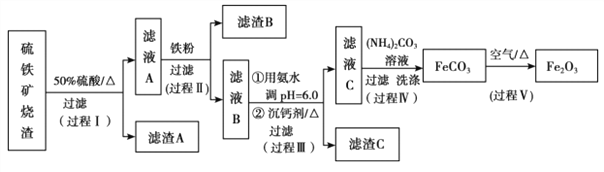
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
已知:生成氢氧化物的 pH 如下表所示
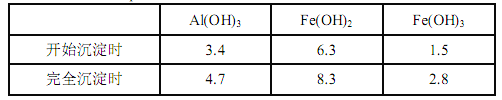
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
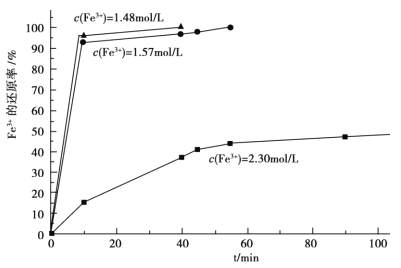
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L1硫酸、6 mol·L1盐酸和蒸馏水)

回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________________。
(2)装置B的作用是______________,装置C的作用是______________,装置E的作用是_____________。
(3)装置D中发生反应的化学方程式是______________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g)==C(g)的能量变化与反应进程关系如图所示,下列说法不正确的是

A. 图中虚线表示加入了催化剂 B. 图中虚线表示的反应I、反应II均为放热反应
C. 加入催化剂,改变了反应历程 D. 该反应的焓变△H=(E2-E1)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化。试回答:
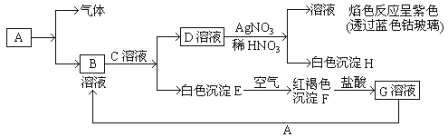
(1)写出B的化学式_____________________D的化学式________________。
(2)写出由E转变成F的化学方程式_____________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式____________________________;向G溶液加入A的有关离子反应方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl 极易溶于水,工业上用 HCl 气体溶于水的方法制取盐酸。
(1)用 12.0mol/L 浓盐酸配置 230mL 0.3mol/L 的稀盐酸,需要量取浓盐酸的体积为___mL;
(2)溶液稀释过程中需要的玻璃仪器有烧杯、玻璃棒、量筒、____________、___________;
(3)溶液稀释过程中有以下操作:
a.量取浓盐酸和一定体积的水,在烧杯中稀释
b.计算所需浓盐酸的体积
c.上下颠倒摇匀
d.加蒸馏水至刻度线 1-2cm 地方,改用胶头滴管加蒸馏水至凹液面与刻度线相切
e.将稀释液转移入容量瓶,洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶,振荡
以上正确的操作顺序为____________________________________________(填序号);
(4)实验过程中的以下操作会导致最终所配溶液浓度(填“偏大”、“偏小”或“不变”)
a.量取浓盐酸时俯视:______________________;
b.量取浓盐酸后,清洗了量筒并将洗涤液转移入容量瓶:______________________;
c.实验前,容量瓶中有少量残留蒸馏水:______________________;
(5)标准状况,1L 水中通入 aL HCl 气体,忽略盐酸溶液中 HCl 的挥发,得到的盐酸溶液密度为 b g/mL,物质的量浓度为 ______________________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com