
| 选项 | 操作 | 现象 | 解释或推论 |
| A | 铁片投入浓硫酸 | 无明显变化 | 常温下铁不与浓硫酸反应 |
| B | 将浓硫酸滴到白纸上 | 白纸变黑 | 浓硫酸强氧化性导致纸张中的纤维素炭化 |
| C | 二氧化硫通入溴水 | 溴水褪色 | 说明二氧化硫具有漂白性 |
| D | 试纸检验某气体 | 试纸变蓝 | 该气体是氨气 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①② | C、①③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.5NA个戊烷分子所占的体积为11.2L |
| B、常温常压下,17g氨气所含电子数为10NA |
| C、2.24L氮气所含的原子数为0.2NA |
| D、NA个氧分子的质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 向绝热恒容密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g)═SO3(g)+NO(g),其正反应速率(v)随时间(t)变化的关系如图所示.下列结论中错误的是( )
向绝热恒容密闭容器中通入SO2和NO2,发生反应SO2(g)+NO2(g)═SO3(g)+NO(g),其正反应速率(v)随时间(t)变化的关系如图所示.下列结论中错误的是( )| A、反应在c点达到平衡状态 |
| B、反应物的浓度:a点大于b点 |
| C、反应物的总能量高于生成物的总能量 |
| D、逆反应速率:c点大于b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、①②④⑥ |
| C、②③④⑥ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用防腐剂延长食品保质期 |
| B、利用风力发电,获取清洁能源 |
| C、研发可降解塑料,控制白色污染 |
| D、将汽车尾气中的NO和CO转化为无害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
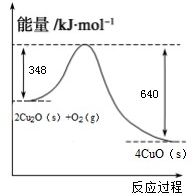 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
| ||
| Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L0.1mol?L-1的FeCl3溶液中有0.1NA个Fe3+ |
| B、Na2O2与H2O反应生成11.2LO2,反应中转移的电子数约为2NA个 |
| C、60g二氧化硅中Si-O键个数为2NA个 |
| D、在标准状况下,Cl2和H2的混合气22.4升,光照后原子总数为2NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com