
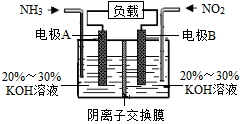
 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( )| A. | 电极B为负极 | |
| B. | 电极A的反应式为2NH3-6e-+6OH-=N2+6H2O | |
| C. | 溶液中OH-通过阴离子交换膜从左向右迁移 | |
| D. | 当有4.48LNO2(标准状况下)被处理时,转移的电子为0.4mol |
分析 由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,负极发生氧化反应,正极发生还原反应,结合电解质溶液呈碱性解答该题.
解答 解:由反应6NO2+8NH3═7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则A为负极,B为正极,
A.B为正极,A为负极,电流由正极经导线流向负极,故A错误;
B.电解质溶液呈碱性,则负极电极方程式为2NH3-6e-+60H-=N2+6H2O,故B正确;
C.原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,所以OH-通过阴离子交换膜从右向左迁移,故C错误;
D.当有4.48L NO2(标准状况)即0.2mol 被处理时,转移电子为0.2mol×(4-0)=0.8mol,故D错误.
故选B.
点评 本题综合考查电解池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握离子移动方向和电极方程式的书写,为解答该类题目的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体无色、透明,能产生丁达尔效应 | |
| B. | SO3溶于水后得到的溶液可以导电,但SO3是非电解质 | |
| C. | 硫酸溶液的导电性一定比醋酸溶液的导电性强 | |
| D. | 用萃取分液的方法除去酒精中的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
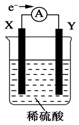 在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | 外电路的电流方向为X→外电路→Y | |
| B. | 若两电极分别为铁和碳棒,则铁棒进行的电极反应式为2H++e-═H2↑ | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 若两电极都是金属,则它们的活动性顺序是X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6gCH2═CHCHO中含有双键的数目为0.1NA | |
| B. | 标准状况下,44.8 L丙三醇与足量金属钠反应,生成气体的分子数为3NA | |
| C. | 粗铜的电解精炼中,阳极质量减轻64g时,转移的电子数为2NA | |
| D. | 15g甲基正离子(+CH3)所含有的电子数是8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应可以快速制取单质铁,工业上常用此法冶炼铁 | |
| B. | NaHCO3能与碱反应,食品工业中用做焙制糕点的膨松剂 | |
| C. | K2FeO4具有强氧化性,其产物水解生成Fe(OH)3胶体,故可用于自来水消毒和净化 | |
| D. | SO2具有漂白性,可用于食品的消毒和漂白 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com