
| A. | CO的燃烧热为566kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1453.28kJ•mol-1 | |
| D. | 完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为221.82 kJ |
分析 A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热;
B.放热反应中反应物的总能量大于生成物的总能量;
C.根据盖斯定律计算,反应热与计量数成正比,方程式的计量数加倍,则反应热也加倍;
D.根据CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 方程式计算.
解答 解:A.1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1,则CO的燃烧热为283.0 kJ•mol-1,故A错误;
B.放热反应中反应物的总能量大于生成物的总能量,所以2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,故B错误;
C.已知:①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ•mol-1 ②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1根据盖斯定律①+②×$\frac{1}{2}$得CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 ,方程式的计量数加倍,则反应热也加倍则2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1,故C正确;
D.CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H1=-726.64kJ•mol-1 ,完全燃烧16g甲醇,生成一氧化碳和水时放出的热量为726.64kJ,故D错误;
故选C.
点评 本题考查了反应热的计算、盖斯定律的应用、热化学方程式的书写等,题目难度不大,注意把握盖斯定律的含义.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
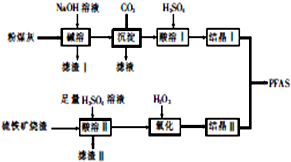 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | 水结成冰体积膨胀,密度变小 | |
| C. | 水分解成氢气和氧气吸收热量 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/(L•s) | B. | 1.5 mol/(L•s) | C. | 2 mol/(L•s) | D. | 3 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚稀溶液常用于外科消毒,所以自来水也可以用苯酚进行消毒处理 | |
| B. | 煤经气化和液化两个化学变化过程,可变为清洁能源 | |
| C. | 石油裂解的目的是提高汽油等轻质油的产量和质量 | |
| D. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com