
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
分析 (1)依据氧化还原反应的元素化合价变化升高和降低相同,结合原子守恒配平化学方程式;
(2)①Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式;
②分液漏斗使用前须进行检漏,向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳,其操作为将碘的四氯化碳溶液置于分液漏斗中,加入适量Na2SO3稀溶液,将分液漏斗充分振荡后静置,分离出下层液体,据此答题;
(3)①溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色;
②根据(1)中反应方程式计算;
③根据I原子守恒找出碘酸钾中碘原子与碘单质的关系式分析计算.
解答 解:(1)该反应中化合价的变化为:KIO3→I2,I元素由+5价→0价,一个KIO3分子得5个电子;KI→I2,I元素由-1价→0价,一个KI分子失一个电子,所以得失电子的最小公倍数为5,KIO3的计量数为1,KI的计量数为5,其它元素根据原子守恒配平,所以反应方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
(2)①Na2SO3稀溶液与I2反应Na2SO3稀溶液具有还原性被氧化为硫酸钠,I2具有氧化性,被还原为I-,结合反应的电荷守恒和原子守恒配平写出离子方程式,Na2SO3稀溶液与I2反应的离子方程式是:I2+SO32-+H2O=2I-+SO42-+2H+,
故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
②分液漏斗使用前须进行检漏,向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳,其操作为将碘的四氯化碳溶液置于分液漏斗中,加入适量Na2SO3稀溶液,将分液漏斗充分振荡后静置,分离出下层液体,所以操作顺序为abdc,
故答案为:检查是否漏水;abdc;
(3)①碘遇淀粉变蓝色,所以溶液呈蓝色,随反应I2+2S2O32-=2I-+S4O62-进行,溶液中没有碘,溶液由蓝色为无色,说明反应到终点,判断c中反应恰好完全所依据的现象是:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色,
故答案为:滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中生成的碘在c中反应I2+2S2O32-═2I-+S4O62-,所以
I2 ~~~~~~2S2O32-,
1mol 2mol
1.0×10-5mol 2.0×10-3mol•L-1×0.0025L×$\frac{100ml}{25ml}$=2.0×10-5mol,
故答案为:1.0×10-5;
③根据KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O可知
I~~~~~KIO3~~~~~3I2
碘酸钾中的碘 127g 3mol
m 1.0×10-5mol
所以m=$\frac{127}{3}$×10-5g,
所以设每千克食盐中含碘$\frac{1000g}{wg}$×$\frac{127}{3}$×10-5g=$\frac{0.423}{w}$g=$\frac{423}{w}$mg,
即为$\frac{423}{w}$mg/kg,
故答案为:$\frac{423}{w}$.
点评 本题考查了氧化还原反应方程式的配平及有关计算,计算时注意是求食盐中碘的含量不是碘酸钾的含量,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀. | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | |
| T |
| A. | Mg在一定条件下可以和YX2发生反应生成Y单质 | |
| B. | 化合物YX2、ZX2化学键类型和晶体类型均相同 | |
| C. | Z、W、T三种元素最高价氧化物的水化物的酸性依次增强 | |
| D. | 五种元素中,只有T是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、糖类、蛋白质均能在一定条件下发生水解反应 | |
| B. | 乙烯能使溴水、高锰酸钾酸性溶液褪色,且褪色原理相同 | |
| C. | 棉、麻、羊毛、蚕丝均属于天然高分子材料 | |
| D. | 石油的分馏与煤的干馏主要是通过物理变化得到成分不同的有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 室温下,NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
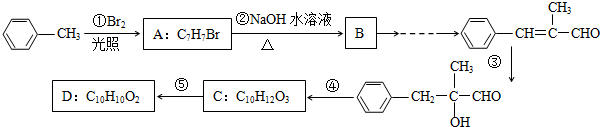

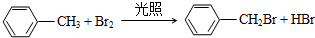 .
. ,无机试剂任选,格式参照图.
,无机试剂任选,格式参照图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
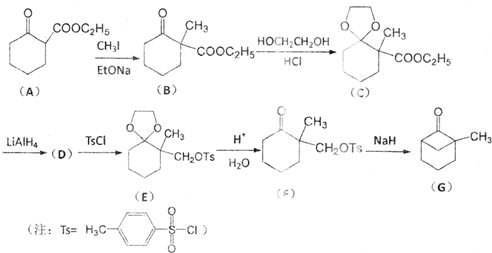
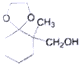 ;
; )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(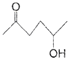 )的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
)的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH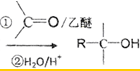
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于1.2 mol | B. | 1.2 mol | C. | 大于1.6 mol | D. | 1.6 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com