
| A. |  利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. |  制备Fe(OH)2:用图所示装置,向试管中加入NaOH溶液,振荡 | |
| D. |  用图装置测定中和热 |
分析 A.氯化铁溶液与氢氧化钠溶液反应生成氢氧化铁沉淀;
B.氯化铵和氢氧化钙在加热条件下生成氨气,氨气密度比空气小;
C.氢氧化亚铁易被氧气氧化而变质;
D.缺少环形玻璃棒.
解答 解:A.实验室制备氢氧化铁胶体,应在沸水中滴加饱和氯化铁溶液,利用水解原理制备,氯化铁溶液与氢氧化钠溶液反应生成氢氧化铁沉淀,得不到胶体,故A错误;
B.实验室用氯化铵和氢氧化钙加热制取氨气,氨气常温下和氧气不反应且密度小于空气,所以采用向下排空气法收集,故B正确;
C.悬空滴加氢氧化钠溶液易携带空气中的氧气,且振荡,生成的氢氧化亚铁易被氧气氧化而变质,故C错误;
D.为迅速反应,减少热量的损失,应用环形玻璃棒,故D错误.
故选B.
点评 本题考查化学实验方案评价,涉及物质的制备、中和热的测定等知识点,为高考高频点,明确实验原理是解本题关键,注意把握实验的严密性和可行性的评价,题目有利于培养学生的分析能力和实验能力,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:多选题
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 3Mg+Fe2O3═3MgO+2Fe | D. | Al+Fe2O3═Al2O3+Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
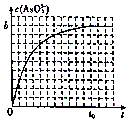 砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:
砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是加成反应 | |
| B. | 若R为CH3时,b中所有原子可能共面 | |
| C. | 若R为C4H9时,取代b苯环上的氢的一氯代物的可能的结构共有12种 | |
| D. | 若R为C4H5O时,lmol b最多可以与6mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钌催化剂能加快该反应的速率 | B. | 升高温度能减慢该反应的速率 | ||
| C. | 达到平衡时,CO2能100%转化为CH4 | D. | 达到平衡时,反应速率:v(正)=v(逆)≠0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氨可用作制冷剂 | |
| B. | 铵态氮肥一般不能与碱性化肥混合使用 | |
| C. | 硝酸可用于制化肥、农药、炸药、染料、盐类等 | |
| D. | 某浓硝酸中含有溶质2 mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1 mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料气和空气的进入量都减少 | |
| B. | 燃料气和空气的进入量都增大 | |
| C. | 减少燃料气进入量或增大空气进入量 | |
| D. | 增大燃料气进入量或减少空气进入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com