
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 抽滤时,滤纸要小于布氏漏斗 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 测定溶液pH的操作:将pH试纸置于表面皿上,用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
分析 A.纸层析法实验中,滤纸作为惰性支持物,滤纸上吸附的水作为固定相,有机溶剂为展开剂,利用离子的溶解能力及随有机溶剂的移动而展开,从而达到分离的目的;
B.减压过滤也称抽滤或吸滤.抽滤时所用的滤纸应略小于布氏漏斗内径;
C.萃取剂的选择应考虑是否反应及溶解性;
D.使用pH试纸时将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较.
解答 解:A.纸层析法实验中,有机溶剂为展开剂,利用离子的溶解能力及随有机溶剂的移动而展开,从而达到分离的目的,展开剂之所以能够展开的主要原理是毛细现象,故A正确;
B.减压过滤也称抽滤或吸滤,抽滤时所用的滤纸应略小于布氏漏斗内径,能将布氏漏斗上全部小孔盖住,故B正确;
C.萃取剂的选择应考虑是否反应及溶解性,萃取操作时,应选择有机萃取剂,且萃取剂与被萃取的物质不反应,与水混合分层,而与密度无关,故C错误;
D.pH试纸不能直接插入到溶液中,使用时不能湿润,应将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较,故D正确;
故选C.
点评 本题考查物质的分离提纯方法原理,为高频考点,把握混合物分离原理及实验操作为解答的关键,注重实验操作的考查,选项AC为解答难点,题目难度较大.


科目:高中化学 来源: 题型:解答题
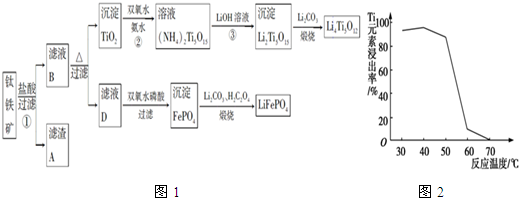
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
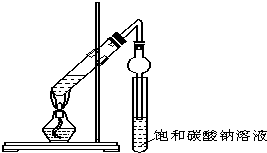 某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:
某同学用下图所示实验装置制取乙酸乙酯.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
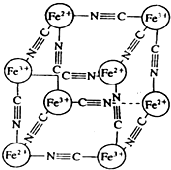 分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )
分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上.其晶体中的阴离子晶胞结构如图示,下列说法不正确的是( )| A. | 该晶体是离子晶体 | |
| B. | M的离子位于上述晶胞面心,呈+2价 | |
| C. | 晶体的化学式可表示为MFe2(CN)6,且M为+1价 | |
| D. | M的离子位于上述晶胞体心,呈+2价 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯中 | B. | 乙酸中 | ||
| C. | 水中 | D. | 乙酸、乙酸乙酯和水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
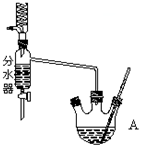 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸馏 | |
| B. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 利用银镜反应进行分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com