
| A. | 平衡后移走部分Z,平衡正向移动 | |
| B. | 若正反应为放热反应,则X一定为气态 | |
| C. | 若X为非气态,则正反应为放热反应 | |
| D. | 若X为气态,再向容器中充入amolX,达到平衡后,X的体积分数增大 |
分析 达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,若平衡向正反应方向移动,则X应为非气态,若平衡向逆反应方向移动,则X应为气态,
A.Z为固态,移走部分Z,平衡不移动;
B.若正反应为放热反应,升高温度平衡向逆反应移动,气体的质量增大,据此判断X的状态;
C.若X为非气态,反应中只有Y为气体,升高温度,Y的质量增大,平衡应向正反应移动;
D.若x为气态,再向容器中充入a mol X,等效为压强增大1倍,平衡向气体体积减小的方向移动,据此判断.
解答 解:达到化学平衡后,升高温度,容器内气体的密度增大,说明气体的质量增大,若平衡向正反应方向移动,则X应为非气态,若平衡向逆反应方向移动,则X应为气态,
A.Z为固态,移走部分Z,平衡不移动,故A错误;
B.若正反应是放热反应,升高温度平衡向逆反应方向移动,容器内气体的密度增大,说明气体的质量增大,则X应为气态才能符合,故B正确;
C.X为非气态,反应中只有Y为气体,升高温度,Y的质量增大,平衡应向正反应移动,故正反应为吸热反应,故C错误;
D.若x为气态,再向容器中充入a mol X,等效为压强增大1倍,平衡向正反应方向移动,与原平衡相比X的体积分数减小,故D错误;
故选B.
点评 本题考查化学平衡的影响因素,题目难度中等,明确容器内气体密度的变化、气体质量的变化是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
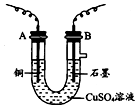 某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.
某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水和四氯化碳可以用分液漏斗进行分离 | |
| B. | 提取溴水中的溴单质,可以用四氯化碳进行萃取 | |
| C. | 可以用高温加热的方法除去CaO中混有的CaCO3 | |
| D. | 可以用蒸发结晶的方法除去KNO3固体中混有的少量NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| B. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )| A. | p3>p4,y轴表示A的物质的量 | |
| B. | p3<p4,y轴表示B的体积分数 | |
| C. | p3<p4,y轴表示混合气体的密度 | |
| D. | p3>p4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
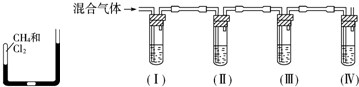
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
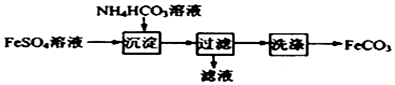
| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com