
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
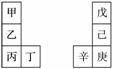
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差11
D.乙的单质在空气中燃烧生成只含离子键的化合物
答案 B
解析 根据特征法(周期表的特殊结构和微粒的特殊性质等)确定出具体元素的名称,再结合元素周期律的知识,逐项进行分析判断。由“戊的一种单质是自然界硬度最大的物质”可知戊为碳元素;由“甲与戊的原子序数相差3”可知,甲为锂元素。A项,同主族元素从上到下金属性逐渐增强,即金属性乙>甲,A错误;B项,同主族元素从上到下原子半径逐渐增大,同周期元素从左到右原子半径逐渐减小,即原子半径大小顺序为庚>己>戊,辛>庚,因此原子半径大小顺序为辛>己>戊,B正确;C项,根据元素周期表的结构可知丙和庚在第四周期中,排在ⅡA族和ⅢA族元素中间的是10种过渡金属元素,从而可知丙与庚的原子序数差为13,C错误;D项,钠在空气中燃烧生成过氧化钠,其中的过氧根离子中存在共价键,D错误。


科目:高中化学 来源: 题型:
判断含氧酸酸性强弱的一条经验规律是含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
| 次氯酸 | 磷酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |
|
|
| 非羟基氧原子数 | 0 | 1 | 3 |
| 酸性 | 弱酸 | 中强酸 | 最强酸 |
(1)亚磷酸H3PO3和亚砷酸H3AsO3分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性。由此可推出它们的结构简式分别为①________________,②________________。
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况:________________________________________________________________________,
写出化学方程式:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是 ( )。
A.电池总反应为Mg+H2O2===Mg(OH)2
B.正极发生的电极反应为H2O2+2H++2e-===2H2O
C.工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)56号元素位于第________周期________族。
(2)114号元素位于第________周期________族。
(3)25号元素位于第________周期________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则下列叙述中正确的是( )
A.原子序数:D>C>B>A
B.原子半径:B>A>C>D
C.离子半径:C3->D->A2+>B+
D.氧化性:A2+>B+,还原性:C3-<D-
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数为110的元素被发现后,它的符号被国际纯粹与应用化学联合会推荐为Ds(德语Darmstadt的缩写),以纪念该元素的发现地——德国。下列关于Ds的说法,不正确的是( )
A.Ds原子的电子层数为7
B.Ds是超铀元素
C.Ds原子的质量数为110
D.Ds为金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
.A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是( )
| B | C |
| D |
A.简单离子的半径大小关系:B>C>E
B.C元素的气态氢化物比D元素的气态氢化物稳定性弱
C.由A、B两种元素组成的离子化合物BA5中,阴、阳离子个数比为1∶1
D.由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知葡萄糖和果糖的分子式为C6H12O6,蔗糖和麦芽糖的分子式为C12H22O11,淀粉和纤维素的分子通式为(C6H10O5)n,都符合通式Cn(H2O)m。
(1)糖类的通式都是Cn(H2O)m吗?
(2)符合通式Cn(H2O)m的有机物都属于糖类吗?
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2 mL 0.1 mol·L-1 FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| Ⅱ | 先向2 mL 0.1 mol·L-1 FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol·L-1 KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加KI溶液后,血红色无明显变化 |
①实验Ⅰ的现象为________________________________________________________________________。
②FeCl2溶液与新制氯水反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL | |
| 0.1 mol·L-1 FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由:________________________________________________________________________。
(3)该同学认为需要进一步设计实验,证明根据实验Ⅲ中现象得出的结论。请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL0.1 mol·L-1 FeCl3溶液,__________ |
(4)上述实验结果表明,Fe3+有可能与I-发生氧化还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变血红的原因,认为Fe3+与I-反应的离子方程式应写为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com