
| A.pH=3的Na2SO4和盐酸的混合溶液中:c(Na+)=2c(SO42-) |
| B.同体积、同物质的量浓度的NaOH溶液和CH3COOH溶液混合,所得溶液中: c(Na+)+c(H+)=c(CH3COO-)+c(OH―) |
| C.酸性溶液中K+、Fe3+、I―、SO42-可以大量共存 |
| D.在0.1mol/L的Na2S溶液中:c(OH―)=c(H+)+c(HS-)+2c(H2S) |
科目:高中化学 来源:不详 题型:单选题
 CH3COO— +H+ 对于该平衡,下列叙述正确的是( )
CH3COO— +H+ 对于该平衡,下列叙述正确的是( )| A.加水稀释时,溶液中所有离子的浓度随之减小 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.10 mol·L—1HCl溶液,溶液中c(H+)不变 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO-+H+达到平衡时,若要使醋酸的电离程度和溶液的pH都增大,应加入的试剂是
CH3COO-+H+达到平衡时,若要使醋酸的电离程度和溶液的pH都增大,应加入的试剂是| A.NH3·H2O | B.HCl | C.CH3COONa | D.NaCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) |
| B.等体积等pH的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 |
| C.将n mol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D.某物质的溶液中由水电离出的c(H+)=1×10-a mol·L-1,若a>7时,则该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲基橙的变色PH范围在4.4~6.2之间。 |
| B.保护海轮外壳以及石油管道通常是用牺牲阳极的阴极保护法。 |
| C.电离常数可以表示弱酸的相对强弱,电离常数越小,弱酸的酸性越强。 |
| D.弱电解质的电离是一个放热过程。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
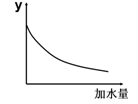
| A.溶液的pH |
| B.醋酸的电离平衡常数 |
| C.溶液的导电能力 |
| D.醋酸的电离程度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质(微粒)及编号 | 电离度α |
| A.硫酸溶液(第一步完全电离): HSO  H++SO H++SO | 10% |
B.硫酸氢钠溶液:HSO H++SO H++SO | 29% |
CH3 COOH COOH CH3COO-+H+ CH3COO-+H+ | 1.33% |
| D.盐酸:HCl=H++Cl- | 100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com