

| ||
| ||
| ||
| 8 |
| 3 |
| 8 |
| 3 |


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
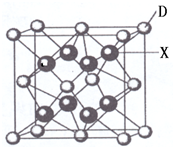 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-770 kJ/mol |
| B、-l220 kJ/mol |
| C、-1500kJ/mol |
| D、-2740kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铵明矾[NH4Al(SO4)2?12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| B、H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
| C、碳酸氢钙溶液中加过量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑ |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
| D、硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、均减半 |
| B、均加倍 |
| C、均增加2mol |
| D、均减少2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com