
分析 (1)①在金属活动顺序表中锡(Sn)位于Fe 与Cu 之间,锡与盐酸可以置换出氢气,Sn与盐酸反应生成SnCl2与H2;
②反应中Cr2O72- 被还原为Cr3+,Fe2+被氧化Fe3+,同时生成水,配平书写离子方程式;
③根据关系式3Sn~3Sn2+~6Fe2+~Cr2O72-计算Sn的物质的量,进而计算Sn的质量,根据定义计算Sn的质量分数;
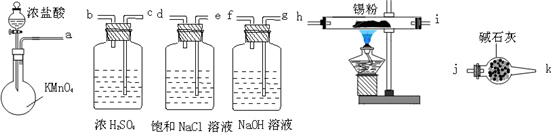
(2)①浓盐酸和高锰酸钾溶液反应生成氯气,氯气中含有水蒸气和氯化氢,通过饱和食盐水除去氯化氢,通过浓硫酸干燥气体,通过硬质玻璃管则的锡粉反应得到无水氯化锡,通过干燥管中碱石灰防止后面水蒸气进入装置E内,使SnCl4水解,最后通过氢氧化钠溶液吸收剩余的氯气,避免污染空气;
②SnCl4易水解,干燥管的作用是防止水进入;
③氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水.
解答 解:(1)在金属活动顺序表中锡(Sn)位于Fe 与Cu 之间,锡与盐酸可以置换出氢气,Sn与盐酸反应生成SnCl2与H2,反应离子方程式为Sn+2H+=Sn2++H2↑.
故答案为:Sn+2H+=Sn2++H2↑;
(2)反应中Cr2O72- 被还原为Cr3+,Fe2+被氧化Fe3+,同时生成水,
反应离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)令样品中Sn物质的量为nmol,则:
3Sn~3Sn2+~6Fe2+~Cr2O72-.
3 1
nmol b mol/L×m×10-3L
解得n=3×b×m×10-3mol,
故样品中Sn的质量为3×b×m×10-3mol×Mg/mol=3×b×m×10-3×Mg
所以样品中Sn的质量分数为 $\frac{3b×m×M×1{0}^{-3}g}{ag}$=$\frac{3bmM}{1000a}$,
故答案为:$\frac{3bmM}{1000a}$;
(2)①浓盐酸和高锰酸钾溶液反应生成氯气,氯气中含有水蒸气和氯化氢,通过饱和食盐水除去氯化氢,通过浓硫酸干燥气体,通过硬质玻璃管则的锡粉反应得到无水氯化锡,通过干燥管中碱石灰防止后面水蒸气进入装置E内,使SnCl4水解,最后通过氢氧化钠溶液吸收剩余的氯气,避免污染空气,装置按气流方向各接口的正确连接顺序是a e f c b h I j k g f,
故答案为:e f c b h I j k;
②干燥管的作用是防止后面水蒸气进入装置E内,使SnCl4水解,
故答案为:防止后面水蒸气进入装置E内,使SnCl4水解;
③氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:Cl2+2OH-═Cl-+ClO-+H2O.
点评 本题考查学生阅读获取信息的能力、常用化学用语、氧化还原滴定的应用、实验流程的分析判断等,题目难度中等,注意利用关系式的计算.


科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 氧化钙 | 蒸馏 |
| B | 乙酸乙酯(乙酸) | 饱和氢氧化钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 过滤 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2固体中所含离子数为0.4NA | |
| B. | 12g金刚石中含有的C-C键个数为1.5NA | |
| C. | 124 g P4含有的P-P键个数为6NA | |
| D. | 60 g SiO2中含Si-O键的个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 标准溶液的体积/mL | 待测溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 21.98 |
| 3 | 25.00 | 0.20 | 20.20 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有SO2和NO | B. | 肯定没有NO2和O2,可能有Cl2 | ||
| C. | 可能有Cl2和O2 | D. | 肯定只有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤④①②③ | B. | ⑤①④②③ | C. | ④①②⑤③ | D. | ③②④①⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com