
| A. | 反应①、②、③都是氧化还原反应 | |
| B. | 反应①中H2O2被还原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反应共转移2mol电子 |
分析 ②反应中元素的化合价没有发生变化,不属于氧化还原反应,可从化合价变化的趋势以及变化的数目分析①③中氧化还原反应有关概念和计算.
解答 解:A、②反应中元素的化合价没有发生变化,不属于氧化还原反应,故A错误;
B、反应①3molH2O2完全被氧化生成3molO2,只做还原剂,被氧化,故B错误;
C、在①反应中,KMnO4为氧化剂,O2为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,氧化性:KMnO4>O2,故C正确;
D、在③反应中,F的化合价由-1价升高到0价,每生成1molF2,反应共转移2mol电子,但在三个反应中还有氧气生成,转移更多的电子,故D错误.
故选C.
点评 本题考查氧化还原反应,题目难度中等,本题易错点为D,注意考虑反应的整体性,不能仅仅分析③.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片加入到少量浓烧碱溶液中:Al+3OH-═Al(OH)3 | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al++6OH-+3SO42-+3Ba2+═2Al(OH)3↓+3BaSO4↓ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++2OH-+SO42-+Ba2+═BaSO4↓+2H2O | |
| D. | 用惰性电极电解 饱和氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl是电解质,所以NH4Cl在溶液通电时可以电离 | |
| B. | Al(OH)3是两性氢氧化物,所以不能用过量的氨水与铝盐制备 | |
| C. | 在铝热剂上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条,就能引发铝热反应 | |
| D. | Al(OH)3胶体的本质特征是能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
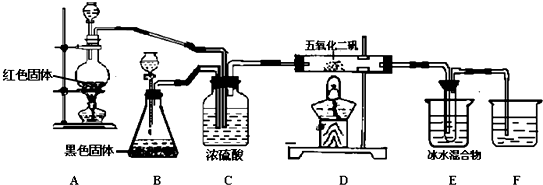
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
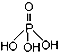 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com