
【题目】某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表,请回答下列问题:
沉淀物 | Fe3+ | Al3+ | Mg2+ |
PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)。
(2)滤渣I的主要成分有 。
(3)从滤液Ⅱ中可回收利用的主要物质有 。
(4)若将MgCl2溶液加热蒸干得到的固体是__________,若要得到MgCl2应采取的操作是___________。
(5)用稀硫酸酸浸时形成滤渣的离子方程式有_____________________。
【答案】(1)升高温度、搅拌、多次浸取等(2分)
(2)Fe(OH)3 Al(OH)3(2分) (3)Na2SO4(1分)
(4) Mg(OH)2(1分) 在HCl的气流中将MgCl2溶液加热蒸干(2分)
(5) MgSiO3+2H+=H2SiO3+Mg2+ (2分)CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O(2分)
【解析】
试题分析:(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;
(2)因MgCO3、CaMg(CO3)2、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、CaSO4、Al2(SO4)3和Fe2(SO4)3,其中CaSO4微溶,形成滤渣;滤液中含有MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3 Al(OH)3;
(3)上述过滤后滤液中阴离子主要是SO42-,加入NaOH后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是Na2SO4;
(4)氯化镁水解生成氢氧化镁和氯化氢,水解吸热,且生成的氯化氢易挥发,因此若将MgCl2溶液加热蒸干得到的固体是氢氧化镁。要得到氯化镁应采取的操作是在HCl的气流中将MgCl2溶液加热蒸干;
(5)由于硅酸镁与稀硫酸反应生成硅酸沉淀,另外硫酸钙微溶,所以用稀硫酸酸浸时形成滤渣的离子方程式有MgSiO3+2H+=H2SiO3+Mg2+、CaMg(CO3)2+SO42-+4H+=CaSO4+Mg2++2CO2↑+2H2O。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】某地区的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的 ( )
A.石蕊溶液 B.四氯化碳 C.氢氧化钠溶液 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~庚等元素在周期表中的相对位置如表所示。己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
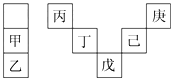
A. 丁的最高价氧化物是人类将太阳能转换为电能的常用材料
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质均能与水剧烈反应
D. 丙与戊的原子序数相差28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)取一定量的泡铜,加入1L0.6mol/LHNO3溶液恰好完全溶解,同时放出2240mLNO气体(标准状况),另取等量的泡铜,用足量的H2还原,得到的铜的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A.“某物质”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物在气态时与相同状况下的H2的密度之比为30∶1,又知12.0 g该有机物与足量钠反应放出0.2 g H2,且不能发生银镜反应,符合条件的有机物可能有( )
A.2种 B.3种 C.4种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确是
A.糖类、油脂、蛋白质完全燃烧只生成CO2和H2O
B.丁烷(C4H10)和二氯甲烷都存在同分异构体
C.向溴水中加入苯,振荡静置后观察下层几乎无色
D.汽油、柴油、植物油都是碳氢化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种常见元素,其中A、B、C、D、E五种元素在周期表中的相对位置如下图所示:
A | B | |||||
C | D | E |
其中B、F形成的二元化合物与D的单质在高温条件下能发生置换反应,该反应可用于焊接铁轨。
回答下列问题:
(1)E在元素周期表中的位置 。
(2)B、C两种元素形成的既含离子键又含共价键的化合物的电子式 。
(3)工业上制备D的单质的方法是电解其 (填字母),阴极反应式为 。
a.氧化物 b.氢氧化物 c.氯化物 d.硫酸盐
(4)常温条件下,向20ml浓度为0.010mol/L的D的氯化物和F的最高价氯化物的混合溶液中逐滴滴入0.020mol/L的NaOH溶液,溶液的pH随着滴入NaOH溶液的变化曲线如图所示:

已知:D和F的最高价氧化物的水化物的溶度积分别为Ksp(D)=1.30×10-33、Ksp(F)=4.0×10-38。
①图像中产生F的最高价氧化物的水化物的沉淀曲线为 (填字母)
a.bc段 b.cd段 c.de段 d.ef段
②沉淀量最大的点为 (填图像中合适的字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com