
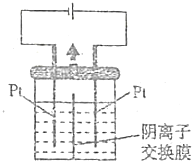
 以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )
以Pt为电极电解淀粉KI溶液的装置如图所示,中间用阴离子交换膜(只允许阴离子通过)将电解槽隔开,则下列观点正确的是( )| A. | 电解过程中左侧发生的电极反应式:40H--4e-═2H2O+O2↑ | |
| B. | 电解过程中左侧溶液中的0H-通过离子交换膜向右侧溶液移动 | |
| C. | 电解一段时间后左、右两侧溶液中的K+的物质的量浓度不变 | |
| D. | 电解初期,右侧溶液能变蓝色,继续电解,溶液的蓝色一定加深 |
分析 电解时,阳极电极反应为:2I--2e-=I2,阴极反应式为:2H2O+2e-=H2↑+2OH-,OH-通过阴离子交换膜向右侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,一段时间后,蓝色变浅,以此解答该题.
解答 解:A.左侧为阴极,发生2H2O+2e-=H2↑+2OH-,故A错误;
B.中间用阴离子交换膜,只允许阴离子通过,右侧为阳极,阴离子向阳极移动,故B正确;
C.钾离子不能透过离子交换膜,左侧消耗水,则钾离子浓度增大,故C错误;
D.OH-通过阴离子交换膜向右侧移动,发生反应3I2+6OH-=IO3-+5I-+3H2O,溶液的蓝色变浅,故D错误.
故选B.
点评 本题考查了电解原理,为高频考点,难度中等,注意C选项为易错点,注意钾离子不能通过阴离子交换膜,注意把握电极方程式的书写方法.


科目:高中化学 来源: 题型:解答题
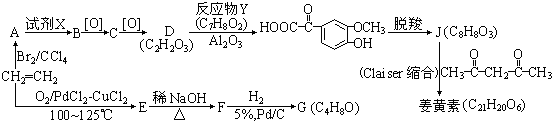
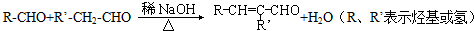
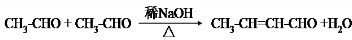 .
.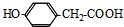 .
.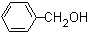 和乙醛为起始原料(其他无机试剂可任选),制备
和乙醛为起始原料(其他无机试剂可任选),制备 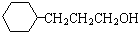 的合成路线,合成路线流程图示例如下:
的合成路线,合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯与HBr加成得到的两种产物,无论通过核磁共振氢谱的吸收峰个数、还是峰面积之比,都可以进行区分 | |
| B. | 实验室制乙炔并探究其性质,需首先通过氢氧化钠,以去除去其中混有的硫化氢、磷化氢等酸性气体 | |
| C. | 利用溴乙烷的消去反应来制乙烯,并探究乙烯与高酸钾溶液反应的情况,需先通过水,防止其中可能混有的乙醇蒸汽干扰 | |
| D. | 乙酸、乙醇酯化反应实验:①使用浓硫酸做催化剂、吸水剂,②加热,及时蒸出乙酸乙酯,③适当过量的乙醇,都是在实验室条件下提高乙酸乙酯产率的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 密度(g/ml-3) | 沸点(℃) | 水溶性 | 溶解性 |
| 甲 | 0.7893 | 78.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
| A. | 分液 | B. | 蒸馏 | C. | 干馏 | D. | 萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂或缩小容器体积,该平衡均不会移动 | |
| B. | 3v(A)=2v(C)=0.16 mol/(L•min) | |
| C. | 升高温度,该平衡正向速率减小,故平衡逆向移动 | |
| D. | 该可逆反应达平衡后,放出a kJ的热能(假设化学能全转化为热能) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH+H2O$→_{△}^{HgSO_{4}}$CH3CHO | |
| B. | C2H5Br+H2O$→_{△}^{NaOH}$C2H5OH+HBr | |
| C. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ +H2O +H2O | |
| D. | CH3COOCH3+H2O$?_{△}^{催化剂}$CH3COOH+CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com