
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源:不详 题型:实验题
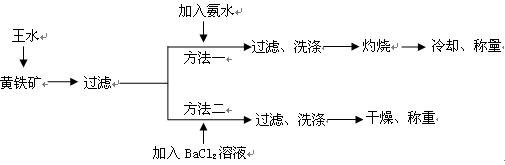
 酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。| A.BaCl2 | B.NaOH | C.Na2SO4 | D.HCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

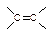 +IBr →
+IBr →
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
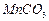 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以 为原料制备少量高纯
为原料制备少量高纯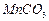 的操作步骤如下:
的操作步骤如下: 溶液:
溶液:
 和水,搅拌,通入
和水,搅拌,通入 和
和 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入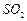 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知 )。
)。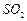 尽可能转化完全,在通入
尽可能转化完全,在通入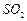 和
和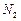 比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。
比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。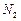 换成空气,测得反应液中
换成空气,测得反应液中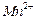 、
、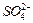 的浓度随反应时间t变化如下图。导致溶液中
的浓度随反应时间t变化如下图。导致溶液中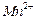 、
、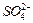 浓度变化产生明显差异的原因是 。
浓度变化产生明显差异的原因是 。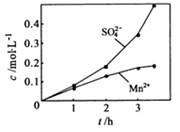
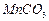 固体:已知
固体:已知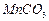 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解; 开始沉淀时
开始沉淀时 。请补充由(1)制得的
。请补充由(1)制得的 溶液制备高纯
溶液制备高纯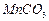 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂: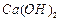 、
、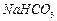 、
、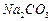 、
、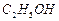 ]。
]。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入盐酸以除去硫酸钠中的少许碳酸钠杂质 |
| B.用洁净的玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH |
| C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大 |
| D.可用25.00ml碱式滴定管量取20.00ml 溴水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.检验某溶液中是否含有甲醛:在盛有2mL10%硫酸铜溶液的试管中,滴加4~8滴10%的氢氧化钠溶液,混合均匀,滴入待检液,加热 |
| B.实验室制乙烯:将浓硫酸与无水乙醇按体积比3∶1混合后迅速加热至170℃ |
| C.制取溴苯:将铁屑、液溴、苯充分混合后加热 |
| D.提取溶解在水中的少量碘:加入植物油振荡、静置、分层后取出有机层再分离 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1mol/LAgNO3溶液的试管中滴加0.1mol/LNaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol/LNa2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 向2mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2 mL苯中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
| D | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热 | 验证淀粉已水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com