
| A. | ①②⑤ | B. | 都不正确 | C. | ④ | D. | ① |
分析 ①在水中,同一水分子中H-O原子之间存在极性键、不同水分子中H-O原子之间存在氢键;
②金属和非金属化合时不一定形成离子键,可能形成共价键;
③离子键是阳离子、阴离子的相互作用力;
④氯化氢电离方程式为HCl═H++Cl-,但HCl中H-O原子之间存在共价键;
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成共价键.
解答 解:①在水中,同一水分子中H-O原子之间存在极性键、不同水分子中H-O原子之间存在氢键,所以水中存在极性键和氢键,故错误;
②金属和非金属化合时不一定形成离子键,可能形成共价键,如氯化铝,故错误;
③离子键是阳离子、阴离子的相互作用力,相互作用力包括吸引力和排斥力,故错误;
④氯化氢电离方程式为HCl═H++Cl-,但HCl中H-O原子之间存在共价键,所以HCl属于共价化合物,故错误;
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成共价键,H、Cl原子之间以共用电子对形成共价键,故错误;
故选B.
点评 本题考查化学键、化合物类型判断,侧重考查基本概念,知道离子化合物和共价化合物的区别,注意不能根据是否含有金属元素判断化学键、氢键不属于化学键,为易错点.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在自然界中只以化合态的形式存在 | B. | 单质常用作光导纤维 | ||
| C. | 最高价氧化物不与酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18个纵横代表18个族,7个主族、8个副族 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共有七个横行代表七个周期 | |
| D. | 第IA族全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 材料 | 主要化学成分 | |
| A | 水泥 | 硅酸盐 |
| B | 光导纤维 | 二氧化硅 |
| C | 碳素钢 | 铁碳合金 |
| D | 漂白液 | 次氯酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
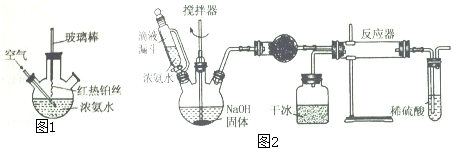
 (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑查看答案和解析>>
科目:高中化学 来源: 题型:解答题
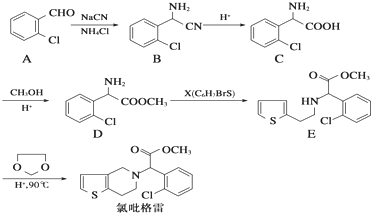 ,
, .
.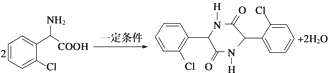 .
.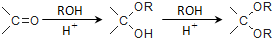 ,则由乙醇、甲醇为有机原料制备化合物
,则由乙醇、甲醇为有机原料制备化合物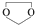 ,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有①②③④(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物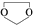 的最后一步反应
的最后一步反应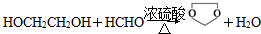 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量CO2与NaOH溶液反应:CO2+2OH-=CO32-+H2O | |
| B. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| C. | 氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ | |
| D. | 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com