
| A、Fe在氯气中燃烧生成FeCl2 |
| B、SiO2的化学性质不活泼,不与任何酸发生反应 |
| C、常温下,铝制品用浓硫酸或浓硝酸处理过,可耐腐蚀 |
| D、铁粉中混有铝粉既可用过量的NaOH溶液,也可以用过量FeCl3溶液充分反应过滤除去 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.
已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.| 反应 | 平衡常数(K) | 反应热(△H) | |
| 900℃ | 1100℃ | 900℃ | |
| ①Fe(s)+CO2(g) FeO(s)+CO(g) | 1.98 | 2.15 | akJ/mol |
| ②Fe(s)+H2O(g) FeO(s)+H2(g) | 1.98 | 1.47 | |
| ③CO(g)+H2O(g)CO2(g)+H2(g) | ckJ/mol | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液操作时,若要回收上层液体,应先从上口倒出上层液体,再从下口将下层液体放出 |
| B、浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 |
| C、AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 |
| D、检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用湿润的pH试纸测稀碱液的pH,测定值偏小 |
| B、酸碱中和滴定时用待测液润洗锥形瓶,所测结果偏高 |
| C、滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 |
| D、测定中和反应的反应热时,将碱缓慢倒入酸中,所测最高温度值偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
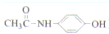 )(以下简称X)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧和关节痛、神经痛、偏头痛等病症,它可用如下方法来合成
)(以下简称X)是最常用的非甾体消炎解热镇痛药,用于治疗感冒发烧和关节痛、神经痛、偏头痛等病症,它可用如下方法来合成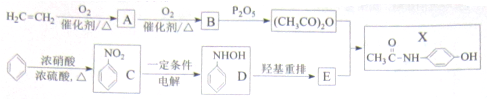
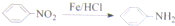 .请回答下列问题:
.请回答下列问题: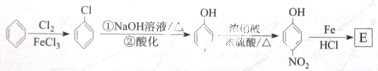
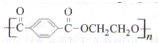 .请设计合成路线(无机试剂及溶剂任选)
.请设计合成路线(无机试剂及溶剂任选)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ | ||
| B、Fe2+ | ||
| C、Al3+ | ||
D、N
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com