
【题目】下列化学方程式中,不能准确表达其变化的是
A.钠在空气中变暗:2Na+O2 =Na2O2
B.蔗糖加浓硫酸变黑:C12H22O11![]() 12C+11H2O
12C+11H2O
C.漂白粉久置失效:Ca(ClO)2+CO2+H2O=CaCO3+ 2HC1O 2HC1O=2HCl+O2
D.SO2形成酸雨:2SO2+O2+2H2O=2H2SO4
【答案】A
【解析】
A. 钠在空气中变暗是因为其被氧化为氧化钠,而不是过氧化钠,A符合题意;
B. 浓硫酸有脱水性,蔗糖加浓硫酸变黑,该变化的化学方程式为C12H22O11![]() 12C+11H2O,B不符合题意;
12C+11H2O,B不符合题意;
C. 漂白粉久置失效是因为其吸收了空气中的水和二氧化碳生成次氯酸,次氯酸见光分解,依次发生反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3+ 2HC1O、2HC1O=2HCl+O2,C不符合题意;
D. SO2形成酸雨是因为其与氧气和水发生反应生成硫酸,形成酸雨的途径通常有两种,但是其总反应均可表示为2SO2+O2+2H2O=2H2SO4,D不符合题意;
本题选A。


科目:高中化学 来源: 题型:
【题目】化学式为C6H12的烃有多种同分异构体,对于其中主链上有4个碳原子且只有一个支链的烯烃,下列说法不正确的是( )
A.该烃的名称为2—乙基—1—丁烯
B.该烃与氢气发生加成反应得到的烷烃的名称为3-甲基戊烷
C.该烃能使溴的四氯化碳溶液褪色,不能与溴发生取代反应
D.该烃能在一定条件下与HCl发生加成反应,得到两种卤代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K14.3×10-7 K25.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka__(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是__(填序号);
a.CO![]() b.ClO-c.CH3COO-d.HCO
b.ClO-c.CH3COO-d.HCO![]()
(3)下列反应不能发生的是__(填序号)
a.CO![]() +CH3COOH=CH3COO-+CO2↑+H2O
+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO![]() +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O=CO![]() +2HClO
+2HClO
(4)体积均为10mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示。

则HX的电离平衡常数__(填“大于”、“等于”或“小于”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)__醋酸溶液中水电离出来的c(H+),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.将装有NO2的玻璃球浸入热水中颜色加深:2NO2(g)![]() N2O4(g) ΔH>0
N2O4(g) ΔH>0
B.用Na2S处理含Hg2+废水:Hg2++S2-=HgS↓
C.Na2S2O3溶液与稀H2SO4混合产生浑浊:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
D.闪锌矿(ZnS)经CuSO4溶液作用转变为铜蓝(CuS):ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀是应用电解原理在某些金属表面镀上一薄层其它金属或合金的方法。在铁质铆钉上镀镍(Ni)能防止铁被腐蚀,如图1。实验室模拟铁片镀镍,装置如图2。

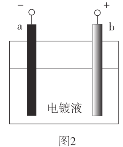
(1)b极材料是__。
(2)电镀液中含有NiSO4、NaCl和硼酸。
已知:NiSO4=Ni2++SO![]() 、Ni2++2H2ONi(OH)2+2H+
、Ni2++2H2ONi(OH)2+2H+
①a极的电极反应式是__。
②硼酸的作用是调节溶液的pH。pH较小时,a极易产生__气体,使镀层疏松多孔。pH较大时,a极会吸附__固体而使镀层含有杂质。
(3)铁质铆钉上镀镍能防止铁被腐蚀是因为镀层使铁与__等物质隔离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
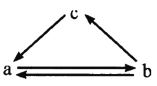
选项物质 | a | b | c |
A | Na2 CO3 | NaHCO3 | CO2 |
B | NO | NO2 | HNO3 |
C | FeCl3 | FeCl2 | Fe |
D | Al2O3 | Al(OH)3 | AlCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,资源化利用CO2具有重要的工业与环境意义。
(1)下列物质理论上可以作为CO2捕获剂的是____(填序号)。
A.NH4Cl溶液 B.(NH4)2CO3溶液 C.氨水 D.稀H2SO4
(2)以TiO2为催化剂的光热化学循环分解CO2反应为碳减排提供了一个新途径。该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
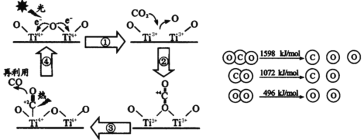
该转化过程①中会____能量(填“吸收”或“释放”);CO2分解反应的热化学方程式为______,实现该反应的能量转化方式是________。
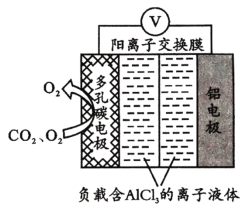
(3)O2辅助的Al-CO2电池能有效利用CO2,且电池反应产物Al2(C2O4)。是重要的化工原料,工作原理如图所示。若正极上CO2还原生成C2O![]() ,则正极的反应式为___;电路中转移1 mol电子,需消耗CO2_____L(标准状况)。
,则正极的反应式为___;电路中转移1 mol电子,需消耗CO2_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料Mg0:MgSO4(s)+CO(g) ![]() MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)△H>0 该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 压强 | CO2与CO的物质的量之比 |
B | 温度 | 容器内混合气体的密度 |
C | MgSO4的质量(忽略体积) | CO的转化率 |
D | SO2的浓度 | 平衡常数K |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
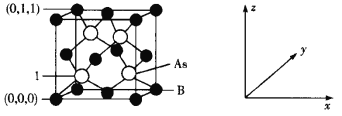
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com