
【题目】抗癌药物“6-Azulenol”的结构简式如图所示,下列有关它的叙述不正确的是
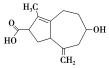
A.分子式为C13H18O3
B.能发生酯化反应、取代反应、还原反应、中和反应、消去反应
C.能使酸性高锰酸钾溶液褪色
D.1 mol该物质最多可以与3 mol H2发生加成反应
科目:高中化学 来源: 题型:
【题目】在体积相同的两个密闭容器中分别充满NO2、N2O4气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A.两种气体的压强相等B.两种气体N原子为1:2
C.两种气体的分子数目相等D.两种气体的氧原子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷石膏是磷氨厂生产硫酸和磷酸所排放的废渣![]() 主要成分为
主要成分为![]() ,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
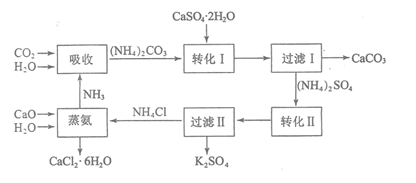
请回答以下问题:
![]() 为了提高原料的利用率,吸收流程中通入
为了提高原料的利用率,吸收流程中通入![]() 和
和![]() 的先后顺序最好为______。
的先后顺序最好为______。
![]() 碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
![]() 工艺流程中除了所给出的
工艺流程中除了所给出的![]() 、
、![]() 、
、![]() 、
、![]() 等原料外,在转化Ⅱ的过程中还需要加入______原料。
等原料外,在转化Ⅱ的过程中还需要加入______原料。
![]() 过滤Ⅱ后所得滤液
过滤Ⅱ后所得滤液![]() 溶液,确认其中含有
溶液,确认其中含有![]() 的方法是:______;
的方法是:______;
![]() 氯化钙结晶水合物
氯化钙结晶水合物![]() 是目前常用的无机储热材料,选择的依据是因为______
是目前常用的无机储热材料,选择的依据是因为______![]() 选填序号
选填序号![]() ;
;
A.熔点较低![]() 熔化
熔化![]()
![]() 能导电
能导电![]() 能制冷
能制冷![]() 无毒
无毒
![]() 已知不同温度下
已知不同温度下![]() 在100g水中达到饱和时溶解的量如下表:
在100g水中达到饱和时溶解的量如下表:
温度 | 0 | 20 | 60 |
|
|
|
|
![]() 时
时![]() 的饱和溶液
的饱和溶液![]() 冷却到
冷却到![]() ,可析出
,可析出![]() 晶体______g。
晶体______g。
![]() 上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______
上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______![]() 均填化学式
均填化学式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含![]() 等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
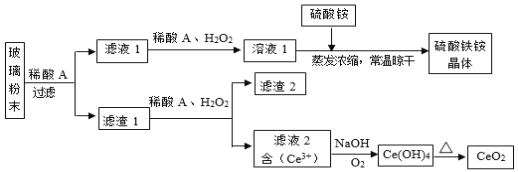
(1)稀酸A的分子式是___________。
(2)滤液1中加入H2O2溶液的目的是___________。
(3)设计实验证明滤液1中含有Fe2+____________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式________________。
(5)由滤液2生成![]() 的离子方程式______________。
的离子方程式______________。
(6)硫酸铁铵晶体![]() 广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是_________。
广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是_________。
(7)取上述流程中得到的![]() 产品0.832g,加硫酸溶解后,用浓度为0.1000
产品0.832g,加硫酸溶解后,用浓度为0.1000![]() 的
的![]() 标准溶液滴定至终点时(铈被还原为
标准溶液滴定至终点时(铈被还原为![]() ),消耗20.00mL标准溶液。该产品中
),消耗20.00mL标准溶液。该产品中![]() 的质量分数为___________。
的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() C(g)+2D(s)。2min末该反应达到平衡,生成D的物质的量如图。下列判断正确的是
C(g)+2D(s)。2min末该反应达到平衡,生成D的物质的量如图。下列判断正确的是

A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动
C.反应过程中A和B的转化率之比为3:1
D.该条件下此反应的化学平衡常数的数值约为0.91
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是
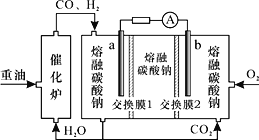
A.O2在b极得电子,最终被还原为![]()
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,![]() 经“交换膜2”移向b极
经“交换膜2”移向b极
D.H2参与的电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺![]() 是合成太阳能敏化剂的原料。一定温度下,在三个体积均为
是合成太阳能敏化剂的原料。一定温度下,在三个体积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]() ,测得有关实验数据如表,下列说法正确的是
,测得有关实验数据如表,下列说法正确的是
容器编号 | 温度 | 起始物质的量 | 平衡时物质的量 | ||||
|
|
|
| CH3NH2(g) |
| ||
Ⅰ | 530 |
|
| 0 | 0 |
| |
Ⅱ | 530 |
|
| 0 | 0 | ||
Ⅲ | 500 | 0 | 0 |
|
|
| |
A.达到平衡时,体系中![]() 关系:
关系:![]() ,Ⅰ
,Ⅰ![]() ,Ⅱ
,Ⅱ![]()
B.达到平衡时,转化率:![]() ,Ⅲ
,Ⅲ![]()
C.正反应的平衡常数![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() Ⅲ
Ⅲ![]()
D.530K时,若起始向容器Ⅰ中充入![]()
![]() 、
、![]() 、
、![]() 、
、![]()
![]() ,则反应将向逆反应方向进行
,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜常用于制船底防污漆。用 CuO 与Cu 高温烧结可制取Cu2O,已知反应:2Cu(s) +O2(g)=2CuO(s)△H= -314kJ/mol;2Cu2O(s)+O2(g)=4CuO(s)△H= -290kJ/mol,则CuOs+Cus=Cu2Os △H 等于
A.-11kJ/molB.-12kJ/molC.+11kJ/molD.-24kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com