
| A、分离四氯化碳和水的混合物用分液漏斗 |
| B、用100 mL的量筒量取5.2 mL的盐酸 |
| C、用托盘天平称取25.20g NaCl |
| D、用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2 (CuO) |
| B、NaOH (NaOH) |
| C、CuSO4 (CuCO3) |
| D、NaCl (NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极发生氧化反应,其主要电极反应式:Ni2++2e-═Ni |
| B、电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C、电解后,溶液中存在的金属阳离子有Fe2+,Zn2+和Ni2+ |
| D、电解后,电解槽底部的阳极泥中含有Cu,Pt和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘在CCl4中的溶解度大于在水中的溶解度 |
| B、萃取后水层颜色变浅 |
| C、萃取后CCl4溶液层为紫红色 |
| D、萃取后水层颜色变红且在下层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
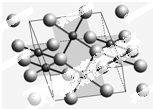 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com