
【题目】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

(1)气体A中的大气污染物可选用下列试剂中的_______吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在__________(填离子符号),检验溶液中还存在Fe2+的方法是_____________________________(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为________________________.
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_________.
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为______________________.
【答案】cd Fe3+ 取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去 3Cu2O+2Al![]() Al2O3+6Cu bd 4H++O2+4e﹣=2H2O
Al2O3+6Cu bd 4H++O2+4e﹣=2H2O
【解析】
由流程可知,黄铜矿加入石英砂通入空气焙烧,可生成Cu2S、CuO,继续加入石英砂通入空气焙烧,生成Cu2O、Cu,生成气体A为二氧化硫,熔渣B为FeO等,Cu2O、Cu与铝在高温下发生铝热反应得到粗铜,电解可得到精铜,据此分析解答。
(1)气体A中的大气污染物主要含二氧化硫,需用碱性溶液吸收,故答案选cd;
(2)滴加KSCN溶液后呈红色,说明存在Fe3+。证明Fe2+的方法一般是用酸性高锰酸钾溶液,使其褪色证明存在Fe2+,具体操作取少量溶液,滴加KMnO4溶液,KMnO4溶液,其现象是酸性高锰酸钾溶液褪色,故答案为:Fe3+;取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去;
(3)由泡铜冶炼粗铜是用铝单质还原Cu2O,发生的化学方程式为
3Cu2O+2Al![]() Al2O3+6Cu,故答案为:3Cu2O+2Al
Al2O3+6Cu,故答案为:3Cu2O+2Al![]() Al2O3+6Cu;
Al2O3+6Cu;
(4)粗铜的精炼中粗铜做阳极,发生氧化反应,纯铜做阴极,与外接电源负极相连,发生还原反应,在电解池中阳离子向阴极移动,在电解过程中还伴随着热量放出,所以电能不可能全部转化为化学能。故选择bd;
(5)原电池中正极发生还原反应,元素化合价降低,在2Cu+O2+2H2SO4=2CuSO4+2H2O中,氧气发生还原反应,所以电极反应式为,4H++O2+4e-=2H2O,故答案为:4H++O2+4e-=2H2O。


科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2min后B的浓度减少0.6mol/L。对此反应速率的正确表示是( )
A.用B、C、D分别表示反应的速率,其比值是3:2:1
B.用A表示的反应速率是0.4mol/(L·min)
C.在2min末的反应速率用B表示是0.3mol/(L·min)
D.在这2min内用B和C表示的速率的值都是逐渐增大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某种胃药的核心合成反应部分过程:
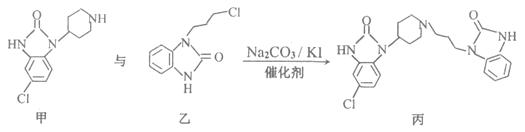
下列说法正确的是( )
A.甲中的两个![]() 键的活性相同B.乙所有原子在同一平面上
键的活性相同B.乙所有原子在同一平面上
C.丙的分子式![]() D.该反应生成丙的原子利用率小于100%
D.该反应生成丙的原子利用率小于100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中需用浓度为0.5mol/L NH4Cl、0.16mol/L KCl、0.24mol/L K2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是( )
A.0.4mol、0.5mol、0.12molB.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24molD.0.64mol、0.02mol、0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~J均为有机化合物,它们之间的转化如下图所示:

实验表明:①D既能发生银镜反应,又能与金属钠反应放出氢气:
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为____________(不考虑立体结构),由A生成B的反应类型是____________反应;
(2)D的结构简式为_____________;
(3)由E生成F的化学方程式为_______________,E中官能团有_________(填名称),与E具有相同官能团的E的同分异构体还有________________(写出结构简式,不考虑立体结构);
(4)G的结构简式为_____________________;
(5)由I生成J的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,Z单质的熔、沸点最低
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g) + H2(g) ΔH1已知:②C4H10(g) +![]() O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) +
O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) + ![]() O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。590 ℃之后,丁烯产率快速降低的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。

(1)G溶液中溶质的化学式为_____________。
(2)请写出反应D→F的化学方程式:_________。
(3)检验F中金属阳离子的常用试剂是______________(填物质的化学式);现象是____________。
(4)E物质可与石灰乳反应制取漂白粉,写出漂白粉的有效成分_________。
(5)写出C与过量氢氧化钠溶液反应的离子方程式_______________。
(6)若向D溶液中滴加氢氧化钠溶液,现象是:____,反应过程中的化学方程式为:____,______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com