
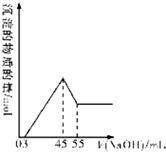
 准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示:
准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示:分析 根据Al2O3是两性氧化物,既溶液强酸又溶于强碱;Fe2O3只溶于强酸,不溶于碱,SiO2只溶于强碱,不溶于酸;铝土矿样品,放入盛有100mL H2SO4溶液的烧杯中,充分反应后过滤,所得溶液中含有Al3+、Fe3+,由图象可知,向滤液中加入10mol•L-1的NaOH溶液,没有沉淀生成,说明硫酸有剩余,继续加入NaOH溶液,铁离子变成氢氧化铁沉淀,将铝离子变成为氢氧化铝沉淀,当加入氢氧化钠共45mL时,沉淀量最大,此时溶液中溶质为硫酸钠,根据钠离子守恒计算硫酸钠的物质的量,再根据硫酸根守恒计算原硫酸溶液中n(H2SO4),再根据c=$\frac{n}{V}$计算,由此分析解答.
解答 解:(1)入氢氧化钠45mL时,沉淀量最大,此时溶液溶质为硫酸钠,根据Na元素守恒有n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.045L×10mol•L-1=0.225mol,根据硫酸根守恒,则有:n(H2SO4)=0.225mol,
所以原硫酸溶液中c(H2SO4)=$\frac{0.225mol}{0.1L}$=2.25 mol/L,
故答案为:2.25 mol/L;
(2)而氢氧化钠体积在45ml到55ml,溶液的是氢氧化铝,反应的方程式为:Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3]=10mol/L×0.01L=0.1mol,故溶液中n(Al3+)=0.1mol,根据Al元素守恒可知n(Al2O3)=$\frac{1}{2}$×0.1mol=0.05mol,故答案为:0.05;
(3)铝离子完全沉淀消耗氢氧化钠的物质的量为0.1mol×3=0.3mol,铁离子、铝离子完全沉淀消耗的氢氧化钠溶液的体积为45mL-3mL=42mL,故该阶段消耗n(NaOH)=0.042L×10mol/L=0.42mol,故铁离子完全沉淀消耗的氢氧化钠的物质的量为0.42mol-0.3mol=0.12mol,
故n(Fe3+)=$\frac{0.12mol}{3}$=0.04mol,故m(Fe2O3)=0.04mol×$\frac{1}{2}$×160g/mol=3.2,m(SiO2)=10-0.05×102-3.2=1.7g,故答案为:1.7.
点评 本题考查混合物的有关计算,侧重于学生的分析能力和计算能力的考查,难度中等,清楚图象中各阶段发生的反应是关键,注意根据守恒的计算,(1)中注意利用反应判断沉淀最大值时,溶液中的溶质,再利用守恒计算,可以简化计算过程.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 离子或分子 | 条件 |
| ① | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| ② | Cu2+、NO3-、S2-、Cl- | 滴加盐酸立即有气体产生 |
| ③ | NH4+、Fe3+、SO42-、HCOOH | 滴加NaOH浓溶液立刻有气体产生 |
| ④ | Na+、HCO3-、Mg2+、SO42- | 逐滴滴加氨水立即有沉淀产生 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LNO2含电子总数为23NA | |
| B. | 3.6gH2O中含有共价键的总数为0.2NA | |
| C. | 若生成的硝酸铜浓度为2mol/L,则1L该溶液中含有的Cu2+数为2N | |
| D. | 若有2molCu参与反应,则有4molHNO3被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
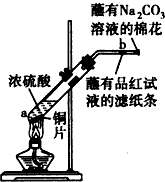 在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热.
在一支试管中放入一块很小的铜片,再加入少量浓硫酸,然后把试管固定在铁架台上.把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中.塞紧试管口,在玻璃导管口处缠放一团蘸有Na2CO3溶液的棉花.给试管加热,观察现象.当试管中的液体逐渐透明时,停止加热. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取一氯乙烷最好采用的方法是乙烷和氯化氢反应 | |
| B. | 化学平衡的标志之一是各物质的浓度相等 | |
| C. | C4H10的同分异构体有3种 | |
| D. | 乙烯能够使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| a | |||||||
| b | c | d | |||||
| e | f | g |
 ;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com