
 、
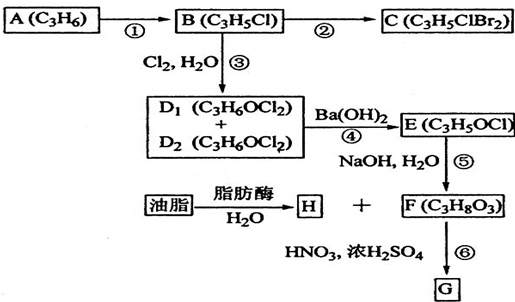
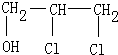
、 中的一种,E和D相比较少了一个氢原子和一个氯原子,D1或D2均生成E,但根据反应⑤可知E不含有双键,故E为
中的一种,E和D相比较少了一个氢原子和一个氯原子,D1或D2均生成E,但根据反应⑤可知E不含有双键,故E为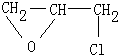 ,又因F是油脂水解得来的物质且可以与硝酸、浓硫酸反应得到G,G应用于医疗、爆破,所以可推出为甘油,G为硝酸甘油酯.
,又因F是油脂水解得来的物质且可以与硝酸、浓硫酸反应得到G,G应用于医疗、爆破,所以可推出为甘油,G为硝酸甘油酯. 、
、 中的一种,E和D相比较少了一个氢原子和一个氯原子,D1或D2均生成E,但根据反应⑤可知E不含有双键,故E为
中的一种,E和D相比较少了一个氢原子和一个氯原子,D1或D2均生成E,但根据反应⑤可知E不含有双键,故E为 ,又因F是油脂水解得来的物质且可以与硝酸、浓硫酸反应得到G,G应用于医疗、爆破,所以可推出为甘油,G为硝酸甘油酯,
,又因F是油脂水解得来的物质且可以与硝酸、浓硫酸反应得到G,G应用于医疗、爆破,所以可推出为甘油,G为硝酸甘油酯, ,
, ;
; ,
, .
.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
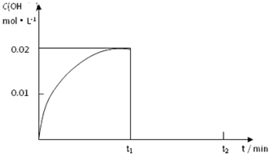 I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)| 加热 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
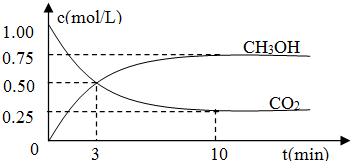
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
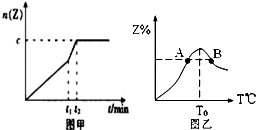 在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0
在一个体积为2L的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:2X(g)+Y(g)?2Z(g);△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.
如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.查看答案和解析>>
科目:高中化学 来源: 题型:
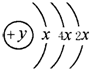 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com