
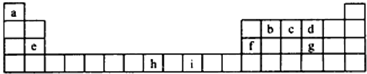
| 6-1×2 |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T | |
| 原子半径(10-10 m) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | |
| 常见化合价 | 最高正价 | +2 | +3 | +6 | +2 | |
| 最低负价 | -2 | -2 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸与锌粒反应:2H++Zn=H2↑+Zn2+ | ||||
| B、用FeCl3溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+ | ||||
| C、向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ | ||||
D、用石墨电极电解食盐水:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| C、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| D、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com