
下列说法正确的是( )
A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
B.吸热反应能自发进行的原因是从外界获得了能量
C.Si02常温下可以与NaOH溶液和HF溶液反应,说明其具有两性
D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.甲基橙呈红色的溶液中:MnO4- 、Al3+ 、 C2H5OH 、SO42-
B.Kw/C(H+)=0.1mol/L的溶液:K+、 Na+、 SiO32-、 NO3-
C.0.1 mol/L AgNO3溶液:H+、 K+、 SO42-、 I-
D.加入苯酚显紫色的溶液:K+ 、 NH4+ 、 Cl-、 I-
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有的溶质是FeBr2、Fel2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是 ( )
①原溶液中的Br一一定被氧化 ②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化 ③不能确定通入氯气后的溶液中是否存在Fe2+ ④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgN03溶液,只产生白色沉淀,说明原溶液中的I一、Fe2+、Br一均被完全氧化 ( )
A.①②③ B.②③④ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列日常生活中的现象与氧化还原反应无关的是
A.铜铸塑像上出现铜绿[Cu2(0H)2C03] B.用石膏点豆腐
C.不良商贩用硫黄熏蒸法制作“白豆芽” D.自来水厂用氯气对水进行消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAl02+6Ag+H20,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知: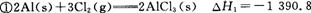 kJ/mol
kJ/mol
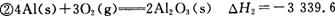 kJ/mol
kJ/mol
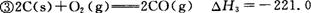 kJ/mol
kJ/mol
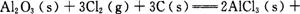
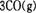 的ΔAH= 。
的ΔAH= 。
 Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
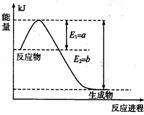
(1)右图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为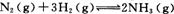 在一定温度下,将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
在一定温度下,将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为 ,有3 m01FeS2参加反应,转移 mol电子。
,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
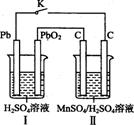 Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnS04溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案设计正确的是
A.分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可用碳酸铵溶液鉴别
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.检验从火星上带回来的红色物体是否是Fe2O3 的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| 现象 | 解释 | |
| A | KI淀粉溶液中通入Cl2,溶液变蓝 | Cl2能与淀粉发生显色反应 |
| B | 浓HNO3在光照条件下变黄 | 浓HNO3不稳定,生成有色产物NO2能溶于浓硝酸 |
| C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO |
| D | 铜片放入浓硫酸中,无明显变化 | 说明铜在冷的浓硫酸中发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球;④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是( )
A.①②③④⑤ B.全部
C.①③④⑤⑥ D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com