
【题目】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为______________________________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.都能与氢氧化钠溶液反应
(3)铍、镁晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点比镁的熔点高,原因是_____________________________________________________。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如图所示的链状结构(c)。

①a属于_____“极性”或“非极性”)分子。
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为________(标出配位键)。
③c中Be原子的杂化方式为_____。
④氯化铍晶体中存在的作用力有_____(填标号)。
A.范德华力 B.σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如图所示。

①BeO晶体中,O2﹣的配位数为_____。
②若BeO晶体的密度为dg/cm3,BeO的摩尔质量为Mg·mol-1,阿伏伽德罗常数为NA,则晶胞参数a=_______________ cm (列出计算式即可)。
【答案】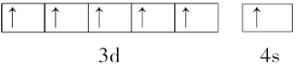 BD Be原子半径比Mg原子半径小,金属键更强 非极性
BD Be原子半径比Mg原子半径小,金属键更强 非极性 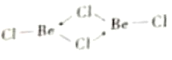 sp3 ABC 4
sp3 ABC 4 ![]()
【解析】
Cr为24号元素,基态Cr原子价电子为3d54s1,其轨道表示式为![]() 。
。
(2);镁铝同一周期,原子序数逐渐增大,所以铝的电负性比镁大。A.铝属于p区主族元素,铍属于s区元素,故A错误;B.铍和铝的性质相似,电负性都比镁大,故B正确;C.铍和镁在同一主族,半径逐渐增大,所以第一电离能都比镁大,铝和镁在同一周期,则铝的第一电离能比镁小,故C错误;D.铍和铝为主族的元素,都在金属和非金属的分界线处,及表现金属性质有表现非金属性质,所以都能和氢氧化钠溶液反应,故D正确。
3)铍、镁在同一主族,都是由金属原子密置层在三维空间堆积而成,铍的原子半径比Mg原子半径小,金属键更强,所以铍的熔点比镁的熔点高。答案:铍原子半径比Mg原子半径小,金属键更强。
(4)①BeC12是直线形分子,正负电荷中心重合,为非极性分子.因此,本题正确答案是:非极性.
②b为BeC12的二聚体(BeC12)2,且所有原子都在平面上,Be中含有空轨道,Cl含有孤电子对,可形成配位键,b的结构式应为:![]() .因此,本题正确答案是:
.因此,本题正确答案是:![]() 。
。
③c为BeC12的长链状分子,一个Be与4个Cl成键,故为sp3杂化.因此,本题正确答案是: sp3。
④氯化铍晶体与AlC13相似, AlC13为共价化合物,则BeC12也为共价化合物,均为分子晶体,分子间为范德华力, BeC12中Be-C1为![]() 键,且Be和Cl电负性不同,为极性键,而分子为非极性分子,所以含有的是ABC.因此,本题正确答案是: ABC。
键,且Be和Cl电负性不同,为极性键,而分子为非极性分子,所以含有的是ABC.因此,本题正确答案是: ABC。
(5))①根据晶胞图,BeO晶体中,O2-周围等径的有4个Be2+,与金刚石晶胞相似,O连接4个Be形成一个四面体,因此O的配位数为4.因此,本题正确答案是:4。
②立方晶胞中,顶点占1/8,面心占1/2,棱上占1/4,内部为整个晶胞所有,则一个BeO晶胞中,含有Be2+数目为8![]() =4,O2-的数目为4,取1mol晶胞,则有NA个晶胞,1mol晶胞的质量为m=4Mg,一个晶胞体积为V0=a3nm3 ,所以1mol晶胞密度为,所以a=
=4,O2-的数目为4,取1mol晶胞,则有NA个晶胞,1mol晶胞的质量为m=4Mg,一个晶胞体积为V0=a3nm3 ,所以1mol晶胞密度为,所以a=![]() 因此,本题正确答案是:
因此,本题正确答案是:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列物质中含有NA个氯化氢分子的是( )
A.将1mol H2和lmol Cl2光照或点燃后的产物
B.室温下22.4L的HCl气体
C.室温下,将1mol HCl气体通入100mL水中所得的液体
D.室温下,36.5g HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________。
水浸与中和步骤得到溶液的操作方法是___________。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应2SO2(g)+O2(g) 2SO3(g) △H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,针对图像下列分析正确的是

A.图I研究的是t1时刻升高温度对反应速率的影响
B.图I研究的是加入合适催化剂对反应速率的影响
C.图II研究的是t1时刻通入氦气(保持恒容)对反应速率的影响
D.图III研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)

(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)

a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。

a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。

①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是
A. 赤色固体可能是Fe2O3
B. 青矾宜密闭保存,防止氧化变质
C. 青矾燃烧过程中发生了电子转移
D. “青矾厂气”可能是CO和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有原子序数小于20的A,B,C,D,E,F6种元素,它们的原子序数依次增大,已知B元素是地壳中含量最多的元素;A和C的价电子数相同,B和D的价电子数也相同,且A和C两元素原子核外电子数之和是B,D两元素原子核内质子数之和的1/2;C,D,E三种元素的基态原子具有相同的电子层数,且E原子的p轨道上电子数比D原子的p轨道上多一个电子;6种元素的基态原子中,F原子的电子层数最多且和A处于同一主族。回答下列问题。
(1)用电子式表示C和E形成化合物的过程________________。
(2)写出基态F原子核外电子排布式__________________。
(3)写出A2D的电子式________,其分子中________(填“含”或“不含”)σ键,________(填“含”或“不含”)π键。
(4)A,B,C共同形成的化合物化学式为________,其中化学键的类型有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钛铁矿(主要成分为钛酸亚铁(FeTiO3),含有MgO、SiO2等杂质)为原料,制备金属钛和铁红的工艺流程如下:

已知:酸溶时,FeTiO3转化为Fe2+和TiO2+
(1)FeTiO3中Ti元素的化合价为_____价,铁红的用途为____________(任写一种)。
(2) “水解”中,发生反应的离子方程式为______________________________。
(3) “沉铁”中,生成的酸性气态产物的电子式为______________;该过程控制反应温度低于35℃,原因为_______________________________________。
(4)FeCO3转化为铁红时,发生的化学方程式为_______________________________。
(5)制得的FeCO3可加入足量的稀硫酸,则从溶液中获得绿矾的操作是_____________。
(6)电解生产钛时用TiO2 和石墨做电极,电解质为熔融的CaO,则阴极的反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1molO3的质量为________,O2的摩尔质量为________,2molO3和3molO2的质量之比为_____,分子数之比为_____,同温同压下的密度之比为_____.含氧原子数之比为_____.
(2)10.6gNa2CO3溶于水配成500mL 溶液,物质的量浓度为_________,其中Na+的物质的量浓度为________。
(3)标准状况下11.2LHCl气体的物质的量为________,所含氢原子与________g CH4中的氢原子数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com