
| A. | ①②⑤ | B. | ①②③④⑤ | C. | ①②⑤⑥⑦ | D. | 全部 |
分析 常见的既能与酸反应又能与碱反应的物质主要有:①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO3、CH3COONH4等;④某些具有两性的金属:Zn、Al等,据此解答.
解答 解:①Al与盐酸反应生成氯化铝和氢气,与氢氧化钠反应生成偏铝酸钠和氢气,故选;
②Al2O3 属于两性氧化物,与盐酸和氢氧化钠反应都生成盐和水,故选;
③AlCl3 与强酸不反应,故不选;
④Na AlO2 与氢氧化钠不反应,故不选;
⑤Al(OH)3 属于两性氢氧化物,与盐酸和氢氧化钠反应都生成盐和水,故选;
⑥NaHCO3与盐酸反应生成氯化钠和水、二氧化碳,与氢氧化钠反应生成碳酸钠和水,故选;
⑦(NH4)2CO3盐酸反应生成氯化铵和水、二氧化碳,与氢氧化钠反应生成碳酸钠、氨气和水,故选;
故选:C.
点评 本题考查元素化合物性质,题目难度不大,注意基础知识的积累,注意具有两性和能与酸、碱反应的区别.


科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| B. | 足量的Fe在Cl2中燃烧生成FeCl2和FeCl3 | |
| C. | 先后将等物质的量的Fe2O3和Fe分别溶于同一稀盐酸时无气体放出 | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3,在给定的条件下能实现转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
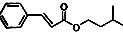 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: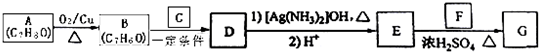
 ;
;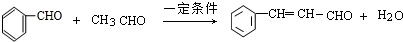 .
.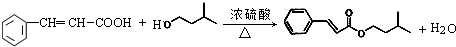 ,反应类型为酯化反应或取代反应.
,反应类型为酯化反应或取代反应.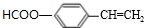 、
、 (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
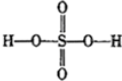 过硫酸:
过硫酸: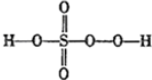
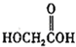 (b)
(b)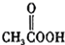 (c)H2O2(d)
(c)H2O2(d) (e)
(e) (f)
(f)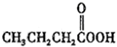 (g)O3(h)
(g)O3(h)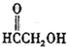
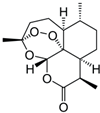
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
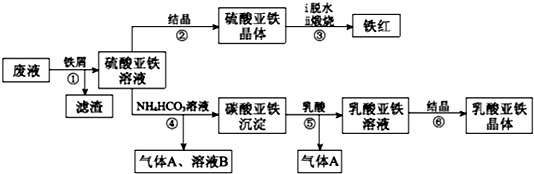
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com