
下列对有关化学用语的理解错误的是( )
A.电子式H: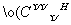 :H可以表示甲基,但是不可以表示CH
:H可以表示甲基,但是不可以表示CH
B.离子结构示意图 可以表示32S2-,又可以表示34S2-
可以表示32S2-,又可以表示34S2-
C.比例模型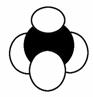 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
D.分子式C3H8O既可以表示1-丙醇,也可以表示2-丙醇
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
| X | Y | ||
| Z | W |
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列各组物质:
A.O2和O3 B. C和
C和 C
C
C.CH3-CH2-CH2-CH3和CH3-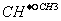 -CH3
-CH3
D.Br- Br和H-
Br和H- Br E.甲烷和庚烷 F.CH3-
Br E.甲烷和庚烷 F.CH3-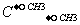 CH3和C(CH3)4
CH3和C(CH3)4
G.CH3COOH与HCOOCH3 H.金刚石与石墨
回答下列问题:
(1)________组互为同位素; (2)________组属于同系物;
(3)________组互为同分异构体; (4)________组是同一物质.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.金属单质与盐溶液的反应都是置换反应
B.4Fe(OH)2+O2+2H2O===4Fe(OH)3属于化合反应
C.SO2+Cl2+2H2O===2HCl+H2SO4属于氧化还原反应
D.反应AgNO3+HCl===AgCl↓+HNO3不能说明盐酸酸性比硝酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
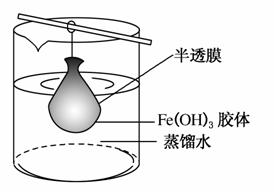
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整:
取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1 mL~2mL饱和________溶液,继续煮沸,待________后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如上图所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察到________(填写“有”或“无”)丁达尔效应;再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为_____________________________。
(3)若将半透膜内的胶体倒入U形管中,如下图所示,在胶体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)________极附近颜色逐渐变深,其原因是____________________。

(4)先取上述半透膜内的Fe(OH)3胶体于试管中,逐滴加入稀硫酸,会发生一系列变化。
①先出现红褐色沉淀,原因是__________________________________
______________________________________________________________;
②随后沉淀溶解,该反应的离子方程式是_________________________
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
LiSOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4SOCl2。电池的总反应可表示为4Li+2SOCl2===4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为__________,发生的电极反应为____________________。
(2)电池正极发生的电极反应为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述浓度的稀硫酸中插入铜片,没有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现电流计指针偏转。
下列关于以上实验设计及现象的分析,不正确的是 ( )。
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验③、④说明该原电池中铜为正极、锌为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2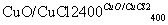 2Cl2+2H2O
2Cl2+2H2O
(1)已知:反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
①H2O的电子式是________。
②反应A的热化学方 程式是______________________
程式是______________________ ____________________________。
____________________________。
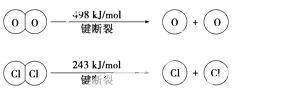
③断开1 mol H-O键与断开1 mol H-Cl键所需能量相差约为________ kJ, H2O中H-O键比HCl中H-Cl键(填“强”或“弱”)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com