
【题目】有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成氢气和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式:
A.________;B.________;C.________。
(2)写出化学方程式:
①C与水蒸气反应______________________________________________________;
②A与水反应_______________________________________________________。
【答案】Na Mg Fe 3Fe+4H2O(g) ![]() Fe3O4+4H2 2Na+2H2O=2NaOH+H2↑
Fe3O4+4H2 2Na+2H2O=2NaOH+H2↑
【解析】
有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体,则A为钠;B也能在空气中剧烈燃烧,发出耀眼的白光,则B为镁;C在一定条件下与水蒸气反应生成H2和一种黑色固体,则C为铁,据此分析。
有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体,则A为钠;B也能在空气中剧烈燃烧,发出耀眼的白光,则B为镁;C在一定条件下与水蒸气反应生成H2和一种黑色固体,则C为铁。
(1)A、B、C的化学式分别为 Na 、 Mg 、 Fe。
(2)化学方程式为
①C与水蒸气反应化学方程式为3Fe+4H2O(g) ![]() Fe3O4+4H2;
Fe3O4+4H2;
②A与水反应化学方程式为2Na+2H2O=2NaOH+H2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为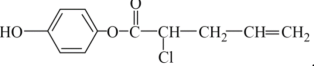 ,其不可能发生的反应有( )
,其不可能发生的反应有( )
①加成反应 ②取代反应 ③消去反应 ④氧化反应 ⑤水解反应 ⑥与氢氧化钠反应 ⑦与稀盐酸反应
A.只有⑦B.①④⑥C.③⑤⑦D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
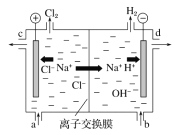
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30g MnO2的质量分数为76.6%的软锰矿石与足量的浓度为12 molL-1的浓盐酸完全反应(杂质不参加反应),试计算:
(1)参加反应的浓盐酸的体积的大小(结果保留3位小数)。____________
(2)在标准状况下,生成Cl2的体积的大小________ (结果保留1位小数,已知软锰矿石与浓盐酸反应的化学方程式为MnO2+4HCl(浓) =MnCl2+Cl2↑+2H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A.NaHCO3能与NaOH反应,可用作食品疏松剂
B.N2的化学性质稳定,可用作粮食保护气
C.Fe2(SO4)3易溶于水,可用作净水剂
D.Al(OH)3受热易分解,可用于制胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠被广泛用于电镀、金的提取以及有机合成中,但含氰废水属于高毒类,必须对其进行处理。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3,说明酸性:HCN__________H2CO3(填“>”或“<”)。
(2)含CN-浓度较低的废水可直接用FeSO4·7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为592 g·mol-1,则M的化学式为___________________。
(3)pH在7.510之间且铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1∶1,则该反应的离子方程式为______________。
(4)工业上常用碱性氯化法处理含氰废水,其原理如下图所示:

①第一阶段的中间体CNCl中碳元素的化合价为__________________。
②某工厂含氰废水中NaCN的含量为14.7 mg·L-1,处理10m3这样的废水,理论上需要5 mol·L-1 NaClO溶液____________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁的工艺流程可表示如下:
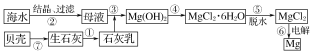
下列说法不正确的是( )
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.上述工艺流程中涉及化合、分解和复分解反应步骤
D.⑤可将晶体置于HCl气体氛围中脱水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 NA是阿伏加德罗常数的值。下列说法正确的是
A.1L1mol/L葡萄糖水溶液中含H-O键的数目为5 NA
B.标准状况下,2.24LCO2和N2O的混合气体所含质子数为2.2 NA
C.1molCH3COOH和3molCH3CH2OH在浓硫酸催化下反应生成酯基的数目为NA
D.常温下,28g铁片投入足量浓硝酸中,转移电子数为1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4.和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
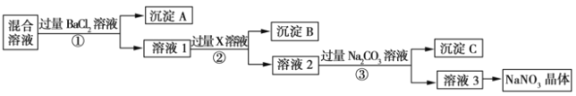
请回答下列问题:
(1)产生沉淀A的离子反应方程式是:________________________;
(2)试剂X是:____________________________________;
(3)上述实验流程中①②③步骤中均要用到的主要玻璃仪器有____________;
(4)上述实验流程中加入过量Na2CO3溶液产生的沉淀C是:________________________。
(5)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的____________ (填化学式),并写出离子反应方程式:_______________________________________________。
(6)溶液3到硝酸钠晶体需要的操作步骤是:________________________洗涤,干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com