
A-E是周期表中1一36号的元素,它们的原子序数依次递增且分别位于前四周期的各个周期中。对它们的性质及结构的描述如下。
A原子的基态只有一种形状的电子云,并容易形成共价键;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素;D元素在周期表中位于C元素的下一周期,其电负性在同周期元素中最大;E原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第IA族元素。
(1)请写出E原子基态的电子排布式____________。
(2)A与C形成的最简单化合物(甲)分子的立体结构是____________,其中C原子的杂化方式是______
(3)A与D元素形成的化合物(乙)与甲相比,沸点较低的是(写化学式)____________原因是________________________
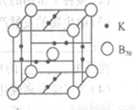
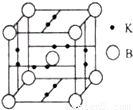
(4)B元素可形成B70单质,它在一定条件下吸收可见光后可高效杀灭癌细胞,有望 成为癌症治疗药物的候选材料。它与金属钾掺杂在一起的化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),则该化合物中B70与钾原子个数比为______。
(8分)
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)
(2)三角锥形(1分);sp3杂化(1分)
(3)HCl(1分);NH3分子之间存在氢键,HCl分子间不存在氢键(1分)
(4)1:3(2分)
【解析】
试题分析:A原子的基态只有一种形状的电子云,容易形成共价键为H;B原子的最外电子层的电子排布可表示为nsnnpn,其元素最高正化合价与最低负化合价的代数和为0,最外层4个电子,说明n=2,为C;C与B同周期,其第一电离能髙于周期表中与之相邻的所有元素,推断只能为N;第三周期电离能最大的D为Cl;在第四周期,最外层1个电子只有K、Cu,排除K,E是Cu。
(1)Cu电子排布式:1s22s22p63s23p63d104s1。
(2)NH3分子的立体结构是:三角锥形;中心原子N的价层电子对数(5+3)/2=4,为sp3杂化。
(3)由于NH3分子间存在氢键,熔沸点较高。
(4)结合晶胞图像可知B70共1/8×8+1=2个,钾原子个数1/2×2×6=6个。
考点:本题考查了元素推断、原子、分子、物质结构及性质。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 (2013?德州一模)【化学一物质结构与性质】
(2013?德州一模)【化学一物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
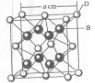 (2011?开封一模)[化学--选修物质结构与性质]
(2011?开封一模)[化学--选修物质结构与性质]| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
| 4×78/mol |
| a3cm3?6.02×1023mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:2013年山东省德州市高考化学一模试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com