
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )
| A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小 |
| C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大 |
D
解析试题分析:由图可知该条件下的CaSO4饱和溶液中溶度积常数K=9.0×10-6(mol/L)2,c(Ca2+)="c" (SO4-)=3.0×10-3mol/L,加入400mL 0.0lmol·L-l的Na2SO4溶液,溶液体积变为500mL,c(Ca2+)=3.0×10-3mol/L/5=6.0×10-4mol/L,c (SO4-)=(3.0×10-3mol/L×0.1L+0.01mol·L-l×0.4L)/0.5L=8.6×10-3mol/L,所以此时c(Ca2+)·c (SO4-)=5.16×10-6(mol/L)2<9.0×10-6(mol/L)2,溶液为不饱和溶液,所以无沉淀析出,排除AC;此时c (SO4-)= 8.6×10-3mol/L>3.0×10-3mol/L,答案选D。
考点:考查沉淀的溶解平衡的判断及有关计算


科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 |
| B.反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0 |
| C.工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 |
| D.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某二元酸(H2A)在水中的电离方程式为:H2A = H+ + HA- HA- H+ + A2- (Ka=1.0×10-2),下列说法正确的是
H+ + A2- (Ka=1.0×10-2),下列说法正确的是
A.在0.1 mol·L-1的H2A溶液中,c(H+)> 0.12 mol·L-1
B.在0.1 mol·L-1的Na2A溶液中,c(A2-)+ c(HA-)+ c(Na+)=" 0.2" mol·L-1
C.分别将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,其pH一定小于7
D.0.1 mol·L-1的NaHA溶液中离子浓度为:c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA |
| C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑ |
| D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T℃时,CaCO3和CaF2的Ksp分别为1.0 ×10-10。和4.0 ×10-12。下列说法正确的是
| A.T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B.T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C.T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D.T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关叙述正确的是 ( )
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO )+c(H2CO3) )+c(H2CO3) |
| B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍 |
| C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强 |
| D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如右图所示。下列有关溶液中离子浓度关系叙述正确的是( )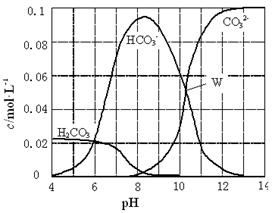
| A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-)=c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是:
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32﹣)减小 |
| C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合溶液中离子浓度: c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣) |
| D.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com