
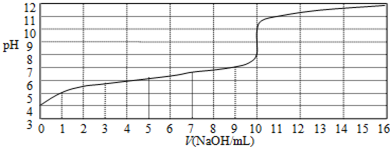
| A. | 此实验可以选用甲基橙作指示剂 | |
| B. | 该酸HA的浓度约为1×10-4mol/L | |
| C. | 当NaOH体积为9 mL时,恰好完全中和反应 | |
| D. | 达到滴定终点时,溶液中c(Na+)>c (A-) |
分析 根据图象可知,0.10mol/L的HA溶液的pH=4,氢离子浓度为1×10-4mol/L,说明HA为弱酸,
A.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂;
B.弱酸部分电离,弱酸的浓度大于溶液中氢离子的浓度;
C.当酸碱恰好反应时,滴定曲线会发生突变;
D.当滴定终点时恰好反应生成强碱弱酸盐NaA,A-部分水解.
解答 解:根据图象可知,0.10mol/L的HA溶液的pH=4,氢离子浓度为1×10-4mol/L,说明HA为弱酸,
A.氢氧化钠和弱酸反应恰好反应生成的盐是强碱弱酸盐,盐水解显碱性,应选择碱性条件下变色的指示剂,应选择酚酞作指示剂,故A错误;
B.弱酸部分电离,弱酸的浓度大于溶液中氢离子的浓度,所以弱酸HA的浓度大于1×10-4mol/L,故B错误;
C.当酸碱恰好反应时,滴定曲线会发生突变,由图象可知,当V=10mL时酸碱恰好中和,故C错误;
D.HA为弱酸,则恰好反应生成生成强碱弱酸盐NaA,由于A-部分水解,则c(Na+)>c(A-),故D正确;
故选D.
点评 本题考查酸碱混合的定性判断和计算,题目难度中等,正确判断HA为弱电解质为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析、理解能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
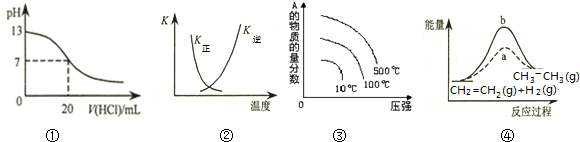
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| C. | 对于可逆反应:A2(g)+3B2(g)?2AB3(g)△H>0,图③表示的是压强、温度、A的物质的量的分数的关系 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g)△H<0,使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁有良好的导热性,常用来制作炊具 | |
| B. | 铜的化学性质不活泼,因此可用于制导线 | |
| C. | 废旧电池中汞的回收可减少对环境的污染 | |
| D. | 钛合金与人体有很好的“相容性,因此可用来制造人造骨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA | |
| C. | 1L0.1mol/LCuCl2溶液中含有Cu2+离子数小于0.1NA | |
| D. | 1mol/L醋酸溶液中含有的H+离子数小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YZ2溶于水形成的溶液具有较强的氧化性 | |
| C. | 1molWM溶于足量水中完全反应共转移2mol电子 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:Fe2+、Cl-、NO3-、Na+ | |
| B. | 石蕊呈蓝色的溶液中:K+、AlO2-、SiO32-、HSO3- | |
| C. | 含大量Al3+的溶液中:K+、Ca2+、NO3-、HCO3- | |
| D. | 含大量OH一的溶液中:CO32-、ClO3-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
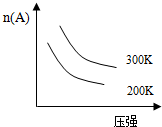
| A. | 3A(g)+B(g)?2C(g);△H<0 | B. | A(g)+3B(s)+2C(g)?3D(g);△H<0 | ||
| C. | C(s)+D(g)?A(g)+B(g)△H>0 | D. | 2C(g)?2A(g)+B(g)△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com