
甲小组以H2O2分解为例,探究外界条件对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)实验①和②的目的是 。进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是 (填一种即可)。
(2)利用实验②和③可知加入FeCl3溶液可以催化H2O2分解,已知FeCl3溶液中含有H2O、Fe3+和Cl-三种粒子,为探究哪种粒子具有催化作用,有如下三种猜想:
猜想1:真正催化分解H2O2的是FeCl3溶液中的H2O
猜想2:真正催化分解H2O2的是FeCl3溶液中的Fe3+
猜想3:真正催化分解H2O2的是FeCl3溶液中的Cl-
你认为最不可能的是猜想 ;理由是 。
(3)同学们又对余下的两种猜想进行了实验探究,请你帮助他们填写下表:
实验步骤 | 实验现象 | 实验结论 |
向盛有5 mL 15%的H2O2溶液的试管中加入少量的HCl,然后把带火星的木条伸入试管中。 | 无明显现象 | ① |
向盛有5 mL 15%的H2O2溶液的试管中加入少量的FeCl3固体,然后把带火星的木条伸入试管中。 | ② | ③ |
乙小组通过Na2S2O3与0.1 mol·L-1 H2SO4反应溶液浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
实验编号 | 温度/℃ | Na2S2O3 | V(H2SO4)/mL | V(H2O)/mL | |
c/mol·L-1 | V/mL | ||||
① | 25 | 0.1 | 5.0 | 10.0 | a |
② | 25 | 0.1 | 10.0 | 10.0 | 0 |
③ | 25 | 0.1 | 5.0 | 5.0 | b |
(4)已知:反应中除生成淡黄色沉淀外还会生成刺激性气味的气体,写出反应离子方程式: ;
(5)若同时选择实验①②、实验①③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中b为 mL。
科目:高中化学 来源:2016-2017学年甘肃省高一上10月月考化学试卷(解析版) 题型:选择题
标准状况下两个容积相等的贮气瓶,一个装O2,一个装CH4,两瓶气体具有相同( )
A.原子总数 B.质量  C.分子数 D.密度
C.分子数 D.密度
查看答案和解析>>
科目:高中化学 来源:2017届福建省四地六校高三上第一次月考化学试卷(解析版) 题型:选择题
将足量CO2逐渐通入KOH和Ca(OH)2的混合溶液中,生成的物质依次是(水除外)( )
A.K2CO3、KHCO3、CaCO3 、Ca(HCO3)2
、Ca(HCO3)2
B.CaCO3、K2CO3、KHCO3、Ca(HCO3)2
C.K2CO3、CaCO3、KHCO3、Ca(HCO3)2
D.K2CO3、CaCO3、KHCO3、Ca(HCO3)2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:填空题
请认真观察下图,然后回答问题:

①图中所示反应是_________(填“吸热”或“放热”)反应,该反应________(填“需要”或“不需要”)加热,该反应的ΔH= kJ/mol(用含E1、E2的代数式表示)。
②已知热化学方程式:H2(g)+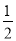 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________kJ/mol。
③对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是:________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省曲靖市高二上第一次月考化学卷(解析版) 题型:选择题
已知化学反应2C(s)+O2(g) 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g) 2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)( )
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)( )
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.12gC所具有的能量一定高于28gCO所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份质量相等的碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g) +3B(g)  2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V,其中C气体的体积占10%。下列推断正确的是
2C(g)。若维持温度和压强不变,当达到平衡时容器的体积为V,其中C气体的体积占10%。下列推断正确的是
A.原混合气体的体积为1.2V B.原混合气体的体积为1.1V
C.反应达平衡时气体B消耗掉0.05V D.反应达到平衡时气体A消耗掉0.05V
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
已知:CO(g)+H2O(g) CO2(g)+H2(g) ∆H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ∆H=– 41 kJ/mol,相同温度下,在体积均为2L的三个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
n(CO) | n(H2O) | n(CO2) | n(H2) | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q1 |
③ | 1 | 1 | 2 | 1 | 热量变化:Q2 |
下列说法中,不正确的是
A.若容器①中反应10min达到平衡,0至10min时间内,用CO表示的平均反应速率υ(CO)=4.0×10-2 mol/(L·min)
B.容器③中,开始时υ(CO)生成>υ(CO)消耗
C.达平衡过程体系能量的变化:Q1=4Q2
D.平衡时,①与②容器中CO的体积分数相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法中正确的说法有几个
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
A.1个 B.2个 C.3个 D.4个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高一上开学考试化学试卷(解析版) 题型:选择题
下列是某学生自己总结的一些规律,其中正确的是( )
A.氧化物不可能是还原产物,只可能是氧化产物
B.饱和溶液一定比不饱和溶液的浓度大
C.有些化学反应不属于化合、分解、置换、复分解中的任何一种反应
D.一种元素可能有多种氧化物,但同种元素的同种化合价只有一种氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com